¿Porque se considera al GLUTATION la Molecula mas Importante de la VIDA?
Esta Molecula ha sido objetivo de Investigacion por mas de un SIGLO, y en la ultima decada ha crecido mucho el avance cientifico e investigaciones , con mas de 150,000 estudios documentados en PUBMED.
A continuacion te vamos a agregar uno de miles de estudios que explican la correlacion del glutation a la mayoria de Enfermedades . Fuente original en INGLES: https://pubmed.ncbi.nlm.nih.gov/19166318/

El glutatión (GSH) desempeña un papel importante en una multitud de procesos celulares, incluida la diferenciación celular, la proliferación y la apoptosis, y como resultado, las alteraciones en la homeostasis GSH están implicadas en la etiología y / o progresión de una serie de enfermedades humanas, incluidas cáncer, enfermedades del envejecimiento, fibrosis quística y enfermedades cardiovasculares, inflamatorias, inmunitarias, metabólicas y neurodegenerativas. Debido a los efectos pleiotrópicos de GSH sobre las funciones celulares, ha sido bastante difícil definir el papel de GSH en el inicio y / o la expresión de enfermedades humanas, aunque se están haciendo progresos significativos. Los niveles de GSH, las tasas de rotación y / o el estado de oxidación pueden verse comprometidos por defectos heredados o adquiridos en las enzimas, transportadores, moléculas de señalización o factores de transcripción que están involucrados en su homeostasis,o por exposición a químicos reactivos o intermedios metabólicos. La deficiencia de GSH o una disminución en la relación GSH / disulfuro de glutatión (GSSG) se manifiesta en gran medida a través de una mayor susceptibilidad al estrés oxidativo, y se cree que el daño resultante está involucrado en enfermedades como el cáncer, la enfermedad de Parkinson y la enfermedad de Alzheimer. Además, los desequilibrios en los niveles de GSH afectan la función del sistema inmunitario y se cree que juegan un papel en el proceso de envejecimiento. Así como los niveles bajos de GSH intracelular disminuyen la capacidad antioxidante celular, los niveles elevados de GSH generalmente aumentan la capacidad antioxidante y la resistencia al estrés oxidativo, y esto se observa en muchas células cancerosas. Los niveles más altos de GSH en algunas células tumorales también se asocian típicamente con niveles más altos de enzimas y transportadores relacionados con GSH.Aunque ni el mecanismo ni las implicaciones de estos cambios están bien definidos, el alto contenido de GSH hace que las células cancerosas sean quimiorresistentes, que es un factor importante que limita el tratamiento farmacológico. El presente informe destaca e integra las conexiones crecientes entre los desequilibrios en la homeostasis de GSH y una multitud de enfermedades humanas.
Palabras clave: Glutatión, enfermedades neurodegenerativas, envejecimiento, cáncer, enfermedades cardiovasculares, enfermedades metabólicas.
Introducción
GSH se requiere para muchos procesos celulares críticos, comprar juega un papel particularmente importante en el mantenimiento y la regulación del estado tiol-redox de la célula ( Meister y Anderson, 1983 ; Meister, 1984 ; Deleve y Kaplowitz, 1990 ; Wang y Ballatori, 1998 ; Sies, 1999 ; Hammond et al., 2001 ; Ballatori et al., 2005 ; Schafer y Buettner, 2001 ). El estado redox de la pareja de disulfuro de GSH / glutatión (GSH / GSSG) puede servir como un indicador importante del ambiente redox ( Jones, 2006 ; Kemp et al., 2008 ; Schafer y Buettner, 2001), y los cambios en esta pareja parecen correlacionarse con la proliferación celular ( Shaw y Chou, 1986 ; Suthanthiran et al., 1990 ), diferenciación ( Nkabyo et al., 2002 ; Esposito et al., 1994 ; Hansen et al., 2001 ; Kim et al., 2004 ; Huh et al., 2005 ), o apoptosis ( Hammond et al., 2001 ; Ballatori et al., 2005 ; Won y Singh, 2006 ; Garcia-Ruiz y Fernandez-Checa, 2007 ; Sykes et al., 2007 ). De importancia, existe una creciente evidencia de que la formación reversible de disulfuros mixtos entre GSH y los residuos de proteínas de cisteinilo con bajo pKa (S- glutatión) es un mecanismo importante para la regulación dinámica postraduccional de una variedad de proteínas reguladoras, estructurales y metabólicas, y para la regulación de la señalización y las rutas metabólicas en sistemas celulares intactos ( Dalle-Donne et al., 2007 ; Ghezzi y Di Simplicio, 2007 ; Mieyal et al., 2008 ).
GSH también juega un papel central en la muerte celular, incluida la muerte celular apoptótica. Se ha demostrado que los niveles de GSH influyen en la actividad de la caspasa, la activación del factor de transcripción, la expresión y función de Bcl-2, la producción de ceramida, la señalización de tiol-redox y la externalización de fosfatidilserina (PS). Otra característica notable de las células que sufren apoptosis es que liberan rápida y selectivamente una gran fracción de su GSH intracelular en el espacio extracelular ( van den Dobbelsteen y otros, 1996 ; Ghibelli y otros, 1998 ; Oda y otros, 1999 ; Hammond et al., 2004 , 2007)
Aunque la extrusión de GSH puede proporcionar un mecanismo simple para eludir las funciones normalmente protectoras de GSH, cada vez hay más pruebas de que se requiere la exportación de GSH para la activación de rutas de señalización apoptóticas específicas y / o para el desmantelamiento adecuado de componentes celulares ( Coppola y Ghibelli, 2000 ; Hammond et al., 2001 ). La exportación de GSH también puede ser necesaria para el co-transporte de moléculas de señalización apoptótica, aunque hay poca evidencia de esta hipótesis.
Dados los muchos procesos celulares importantes que están influenciados por los niveles de GSH, no es sorprendente que las alteraciones en la homeostasis de GSH hayan estado implicadas en la etiología y / o progresión de una serie de enfermedades humanas ( Cerutti, 1985 ; Ballatori et al., 2005 ; Estrela et al., 2006 ; Franco et al., 2007 ; Kinnula et al., 2007 ; Liu et al., 2004 ; Reynolds et al., 2007 ; Seifried et al., 2007 ; Townsend et al., 2003 ; Vali et al., 2007 ; Valko et al., 2007) Sin embargo, dados los muchos papeles que desempeña GSH, ha sido difícil atribuir relaciones causales entre los cambios en los niveles de GSH o el estado redox y el desarrollo de la enfermedad. El presente informe resume los avances en el campo e integra los hallazgos de diversas disciplinas para dilucidar posibles mecanismos y vías comunes que contribuyen a la enfermedad humana.
GSH homeostasis
En condiciones normales, los niveles celulares de GSH están regulados por dos mecanismos principales: controlando las tasas de su síntesis y de su exportación desde las células; sin embargo, los niveles de GSH también están influenciados por agentes o condiciones que alteran el estado redox de tiol, que conducen a la formación de conjugados o complejos de glutatión S y / o que interrumpen la distribución de GSH entre varios orgánulos intracelulares. Además, los niveles de GSH se ven afectados por el estado nutricional y los niveles hormonales / de estrés, exhiben variaciones de desarrollo y diurnas, y se ven afectados por ciertos estados fisiológicos, incluidos el embarazo y el ejercicio( DeLeve y Kaplowitz, 1990 ; Hahn et al., 1978 ; Isaacs y Binkley, 1977 ; Kemp et al., 2008; Lauterburg et al., 1984 ; Meister y Tate, 1976 ; Meister y Anderson, 1983 ; Uhlig y Wendel, 1992 )La síntesis y el catabolismo de GSH y sus aductos se produce mediante una serie regulada de etapas de transporte enzimático y de membrana plasmática que se denominan colectivamente ciclo γ-glutamilo Figura 1) ( Meister y Tate, 1976 ; Meister y Anderson, 1983 )GSH se sintetiza en cada célula de eucariotas superiores, aunque las tasas de síntesis y recambio de GSH, y las concentraciones intracelulares difieren entre células y tejidos. ( Hahn et al., 1978 ; Lauterburg et al., 1984 ; Meister y Tate, 1976 ; Meister y Anderson, 1983 ; Uhlig y Wendel, 1992 ).GSH se sintetiza en el citosol celular a partir de sus aminoácidos precursores por las enzimas que requieren ATP γ-glutamilcisteína ligasa y GSH sintetasa (Figura 1A) La tasa de síntesis de GSH está controlada en gran medida por la expresión y la actividad catalítica de la primera enzima en su biosíntesis, γ-glutamilcisteína ligasa, y por la disponibilidad de cisteína ( Dalton et al., 2004 ; Dickinson et al., 2004 ; Meister y Tate, 1976 ; Meister y Anderson, 1983 ). La expresión de la γ-glutamilcisteína ligasa está sujeta a la regulación por Nrf2, un factor de transcripción que regula una amplia gama de genes dirigidos por elementos que responden a los antioxidantes (ARE) en varios tipos de células, y por lo tanto juega un papel central en las defensas antioxidantes celulares ( Jaiswal, 2004 ; Lee y Johnson, 2004 ; Wild y Mulcahy, 2000 ).
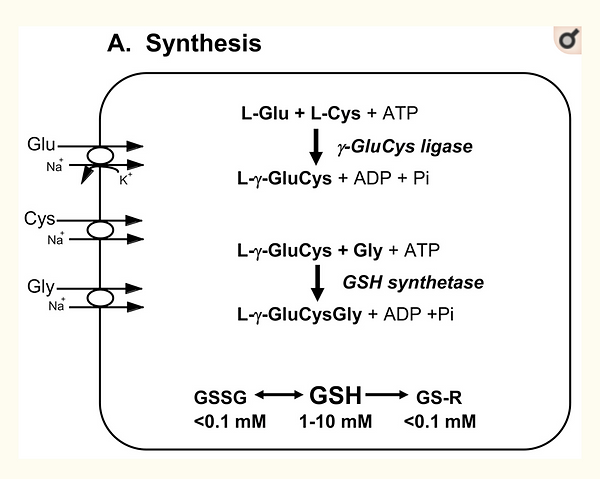



Principales vías de homeostasis del glutatión en células de mamíferos
(A) GSH se sintetiza en el citosol celular a partir de sus aminoácidos precursores, glutamato, cisteína y glicina. Dentro de la célula, existe principalmente (> 98%) en la forma reducida en tiol (GSH), pero algo también está presente como disulfuro de glutatión (GSSG) y como conjugados de glutatión (GS-R). (SI)Después de su síntesis, parte de la GSH se entrega en compartimentos intracelulares específicos, incluidas las mitocondrias y el retículo endoplásmico, pero gran parte de la GSH se entrega a espacios extracelulares, como plasma sanguíneo, secreciones exocrinas, líquido de revestimiento pulmonar y líquido cefalorraquídeo. En las células polarizadas, el transporte de GSH y sus conjugados a través de la membrana apical está mediado en gran parte por MRP2, mientras que MRP1 y Oatp1 de rata pueden contribuir al flujo de salida de GSH a través de la membrana plasmática basolateral hacia el plasma sanguíneo, aunque las proteínas específicas que median la exportación de GSH y la compartimentación intracelular permanecen mal definidos. (C)A diferencia de la síntesis de GSH, que ocurre intracelularmente, la degradación de GSH ocurre exclusivamente en el espacio extracelular, y solo en la superficie de las células que expresan la ectoenzima γ-glutamil transpeptidasa. Esta enzima se encuentra en la membrana apical de muchas células epiteliales, pero también es abundante en otros sitios clave, incluido el compartimento basolateral del riñón. Una vez que los compuestos que contienen GSH y GSH se exportan de las células, existen ciclos eficientes e intraorganismos de degradación y utilización del glutatión que consisten en: (a) catabolismo extenso dentro de los espacios apicales (p. Ej., Bilis y líquido tubular renal) como dentro de compartimientos sinusoidales de algunas especies; (b) la recaptación celular de algunos de los productos de descomposición; y (c) utilización intracelular de estos productos de descomposición, o conversión de cisteína S-conjugados (Cys-SR) a ácidos mercaptúricos, es decir, N- acetilcisteína S -conjugados (N-acetil-Cys-SR). Como se ilustra en este panel, el catabolismo de los conjugados de glutatión S (GS-R) conduce a la formación de conjugados de cisteína S (Cys-SR). Los Cys-SR se transportan de regreso a las células, donde pueden ser sustratos para el N-acetiltransferasas, para generar N-acetil-Cys-SR, o ácidos mercaptúricos. Los ácidos mercaptúricos se exportan desde las células para su eventual eliminación en orina o heces, pero los mecanismos de transporte no están claramente definidos. Tenga en cuenta que la γ-glutamil transpeptidasa puede catalizar reacciones de hidrólisis, para liberar L-Glu libre, o reacciones de transpeptidación, para conducir a la formación de γ-Glu unida a aminoácidos o péptidos (γ-Glu-AA). Estos γ-Glu-AA pueden transportarse de regreso a las células, donde son sustratos de la enzima γ-glutamil ciclotransferasa: esta enzima genera 5-oxoprolina y libera el aminoácido o péptido que se une a L-Glu. La 5-oxoprolina se convierte en L-Glu por la enzima 5-oxoprolinasa que requiere ATP. (RE)GSH es un cofactor, coenzima y / o sustrato para una serie de enzimas, y puede participar en una serie de reacciones redox y de conjugación. En particular, GSH puede reaccionar con muchos productos químicos electrofílicos para generar glutatión S- conjugados (GS-R). Aunque las reacciones de conjugación pueden ocurrir espontáneamente, estas reacciones a menudo son catalizadas por las transferasas de glutatión S (GST). GSH también facilita la reducción de oxidantes a través de glutatión peroxidasas (GPX), y está involucrado en el mantenimiento del estado redox de los tioles de proteínas a través de las enzimas glutaredoxinas (GRX), tiorredoxinas (TRX) y peroxiredoxinas (PRX).
Dentro de la célula, el tripéptido existe principalmente (> 98%) en la forma reducida en tiol (GSH), pero algunos también están presentes como disulfuro de glutatión (GSSG), así como una variedad de formas de tioéter, mercaptidos u otras formas de tioéster (glutatión S -conjugados) (tabla 1 y Tabla 2) Después de su síntesis, el GSH se administra a otros compartimentos intracelulares, incluidas las mitocondrias, el retículo endoplásmico, el núcleo y el espacio extracelular (p. Ej., Plasma sanguíneo y bilis) para su utilización por otras células y tejidos (Figura 1B) El transporte de GSH a las mitocondrias parece estar mediado en parte por el portador de dicarboxilato (DIC, Slc25a10) y el portador de oxoglutarato (OGC, Slc25a11) ( Lash, 2006 ), mientras que el transporte hacia el núcleo probablemente ocurre por difusión pasiva a través de los poros nucleares. El mecanismo de transporte de GSH al retículo endoplásmico permanece indefinido, aunque se ha sugerido un papel para el canal del receptor de rianodina en las membranas del retículo sarcoplásmico del músculo esquelético ( Csala et al., 2003 ).
Tabla 1
Glutatión endógeno S -conjugados y complejos
Tioéteres:
Acetoacetilo
Acetilo
Acidos biliares acil-adenilados *
Tioésteres de acil-CoA de ácidos biliares *
β-alanil-dopa
Antocianinas *
Auxinas *
Catecol estrógeno quinonas *
Colesterol-5,6-óxido
Citoquininas *
Dicarboxietil
Dopa
Dopamina
17-β-estradiol
Etilo
Flavonoides *
Hepoxilina A 3
Hidroxietilo
4-hidroxihexenal
4-hidroxinenal
5-hidroxitriptamina
5-hidroxitriptófano
Indoles *
Leucotrienos C 4
Productos de oxidación de ácido linoleico *
Menadione
Metilo
α-metildopamina
Metilglioxal
Óxido nítrico
Ácido nitrolinoleico
Ácido 13-oxooctadecadienoico
Palmityl
Porfirinas *
PGJ 2 , PGD 2 , PGA 1 , PGA 2
Quinonas *
Tetrapirrol *
Ácido trans urocanico
Tioésteres:
Coenzima A
Cisteína
Cisteinilglicina
GSH
Sulfato
Mercaptidos:
Cr
Cu (I)
Cu (II)
Se
Zn
Esta tabla identifica algunos de los compuestos endógenos que se sabe que existen como glutatión S- conjugados en mamíferos.
* Solo ciertos miembros de estas clases de productos químicos pueden formar conjugados de glutatión. Ver Wang y Ballatori (1998) para una revisión previa de esta área.
Tabla 2
Proteínas Glutationiladas
Enzimas con tioles de sitio activo:
Aldosa reductasa
Anhidrasa carbónica III
Caspase 3
Creatina quinasa
GAPDH
Proteasa del VIH-1
α-cetoglutarato deshidrogenasa
Paraoxonasa 1
Tirosina hidroxilasa
Factores de transcripción:
AP-1
c-jun
NF-kB
IKK subunidad β
Factor regulador de interferón 3 (IRF3)
p53
Pax-8
Proteínas de señalización:
Akt
Hsp60
Hsp70
Receptor de insulina PTP-1B
Keap1
Proteína quinasa A
Proteína quinasa C
MEKK1 (MAPK / ERK quinasa quinasa 1; MAP3K)
STAT3
Células T p59fyn quinasa
Proteína tirosina fosfatasa-1B
Ras
Canales iónicos y bombas de Ca 2+ :
RyR1
CFTR
SERCA
Otras proteinas:
Actina
Aconitasa
Ciclofilina A
Hemoglobina
Complejo I (NADH-ubiquinona oxidorreductasa)
Isocitrato deshidrogenasa
Miosina
Proteína Neuronal Tau
Tiorredoxina 1
Tubulina
Esta tabla identifica algunas de las proteínas que pueden formar glutatión S- conjugados en mamíferos.
Ver Dalle-Donne et al., 2007 , Ghezzi y Di Simplicio, 2007 , y Mieyal et al., 2008 para revisiones de esta área.
A diferencia de la síntesis de GSH, que ocurre intracelularmente, la degradación de GSH ocurre exclusivamente en el espacio extracelular y, en particular, en la superficie de las células que expresan la ectoenzima γ-glutamil transpeptidasa (también llamada γ-glutamil transferasa o GGT) (Figura 1C) La γ-glutamil transpeptidasa, que es abundante en la superficie apical de la mayoría de los epitelios transportadores, incluidas las membranas canalicular y biliar del hígado, es la única enzima que puede iniciar el catabolismo de las moléculas que contienen GSH y GSH (p. ej., GSSG, glutatión S- conjugados, y complejos de glutatión) en condiciones fisiológicas. La γ-glutamil transpeptidasa es una glicoproteína heterodimérica que cataliza la hidrólisis y la transpeptidación del grupo γ-glutamilo de GSH y compuestos relacionados. En el animal adulto, los niveles altos de γ-glutamil transpeptidasa se expresan constitutivamente en el riñón, el intestino y el epidídimo. Esta enzima se expresa en un patrón específico del estadio específico del tejido y del desarrollo y es inducida por varios xenobióticos ( Ikeda y Taniguchi, 2005) Esta expresión diferencial de γ-glutamil transpeptidasa es conferida por diferentes promotores en las regiones 5 'no traducidas de ARNm generados en diferentes tejidos y en diferentes etapas de desarrollo ( Ikeda y Taniguchi, 2005 ).
Como la γ-glutamil transpeptidasa es una enzima unida a la membrana plasmática con su sitio activo en la superficie extracelular de la membrana, la exportación de GSH y sus aductos al espacio extracelular es el paso inicial y presumiblemente regulado en su renovación en todas las células de mamíferos. A pesar de la importancia de este paso de transporte, se sabe relativamente poco a nivel molecular sobre los transportadores GSH de membrana plasmática ( Ballatori et al., 2005 , 2008 ). La escasez de información se explica en gran parte por una serie de limitaciones prácticas y teóricas que han obstaculizado la caracterización funcional y molecular de los transportadores GSH ( Ballatori et al., 2005 , 2008 ).
Una vez que los compuestos que contienen GSH y GSH se liberan de las células, existen ciclos eficientes de degradación y utilización de glutatión dentro y entre órganos (Figura 1D) ( Ballatori et al., 2005 ). En el hígado, un sitio importante del metabolismo de GSH, este consiste en: a) catabolismo extenso de GSH dentro de los espacios biliares ( Ballatori et al., 1986b , 1988 , 1989 ), así como dentro de los compartimentos sinusoidales de algunas especies ( Hinchman y Ballatori , 1990 , 1994 ), b) reabsorción hepática directa de algunos de los productos de descomposición ( Ballatori et al., 1986a , 1988 ; Simmons et al., 1991 , 1992 ), yc) utilización intracelular de los aminoácidos, o conversión de cisteína S-conjugados a ácidos mercaptúricos, es decir, N -acetilcisteína S -conjugados ( Hinchman et al., 1991 , 1993 , 1998 ). Como se señaló anteriormente, esta compleja serie de pasos sintéticos, catabólicos y de transporte de GSH se conoce como el ciclo γ-glutamilo, y está íntimamente asociado con las funciones del tripéptido. Algunas de las funciones de este ciclo incluyen la regulación del recambio de GSH, el estado tiol-redox de la célula, la biosíntesis de ácido mercaptúrico, el transporte y la excreción de metales.
Una función adicional del transporte de GSH a la bilis hepática es servir como fuerza impulsora osmótica primaria en la formación de bilis ( Ballatori y Truong, 1989 , 1992 ). GSH es la molécula orgánica más abundante en la bilis a una concentración de 8-10 mM. La concentración de ácidos biliares libres (no asociados a micelas) en la bilis hepática de rata es menor (solo 1 a 3 mM), y los pigmentos biliares son ~ 1 mM. La alta concentración de GSH en la bilis canalicular junto con su carácter hidrofílico (alto coeficiente de reflexión osmótica) genera una potente fuerza impulsora osmótica para la secreción de bilis ( Ballatori y Truong, 1992) La hidrólisis de GSH en sus tres aminoácidos constituyentes dentro de los espacios biliares libera de manera efectiva tres equivalentes osmolares a la bilis, lo que impulsa la absorción de agua a través de la vía paracelular, o a través del hepatocito a través de una vía no mediada por canales, y en consecuencia alimenta el flujo de bilis .
Cuando se exponen al estrés oxidativo o a los productos químicos electrofílicos, se generan GSSG y glutatión S- conjugados dentro de la célula. Estas reacciones químicas se han caracterizado ampliamente por una multitud de productos químicos extraños, pero también son críticas para la desintoxicación de intermedios reactivos endógenos y, lo que es más importante, para la formación de mediadores biológicos específicos ( Wang y Ballatori, 1998 ). Por ejemplo, GSH forma conjugados de tioéter con leucotrienos, prostaglandinas, hepoxilina, óxido nítrico, hidroxialquenales, ácido ascórbico, dopa, dopamina y ácido maleico, y forma tioésteres con cisteína, coenzima A, proteínas y otros tioles celulares (tabla 1 y Tabla 2) GSH también se une a metales endógenos como Cu, Se, Cr y Zn a través de reacciones no enzimáticas (tabla 1) De importancia, la glutatión de los péptidos y proteínas celulares es cada vez más reconocida como un mecanismo regulador y de señalización celular ( Dalle-Donne et al., 2007 ; Ghezzi y Di Simplicio, 2007 ; y Mieyal et al., 2008 ). Se informa que una variedad de enzimas, factores de transcripción, proteínas de señalización, factores de crecimiento, canales iónicos y citocinas sufren glutatión reversible (Tabla 2) Actualmente, no se ha demostrado que ninguna enzima sirva como catalizador de S -glutationilación in situ , aunque desempeña funciones para la glutaredoxina-1 humana (GRX1;Figura 1D), y para la isoforma pi de glutatión-S-transferasa (GSTpi) se han propuesto ( Mieyal et al., 2008 ). La desglutionilación parece estar catalizada por las glutaredoxinas (GRX;Figura 1D), con quizás una contribución de las tiorredoxinas (TRX). Estudios recientes aportan pruebas contundentes de que la proteína S- glutationilación es una modificación postraduccional importante, que brinda protección a las proteínas cisteínas de la oxidación irreversible y sirve para transducir señales redox ( Dalle-Donne et al., 2007 ; Ghezzi y Di Simplicio, 2007 ; Kemp et al., 2008 ; y Mieyal et al., 2008 ).
Después de su síntesis dentro de la célula, se pueden exportar GSSG y glutatión S- conjugados de las células, un proceso mediado principalmente por las proteínas asociadas a la resistencia a múltiples fármacos (MRP / ABCC). Se han identificado un total de nueve genes MRP funcionales ( MRP1 / ABCC1 a MRP9 / ABCC9 ), aunque las funciones fisiológicas de muchos MRP permanecen indefinidas (Borst y Oude Elferink, 2002; Kruh et al., 2007 ). En general, los MRP funcionan como bombas de exportación de aniones orgánicos, y parecen tener una especificidad de sustrato amplia y parcialmente superpuesta. Muchos de los MRP aceptan sustratos de glutatión S como sustratos ( Ballatori et al., 2008 ).
Estudios recientes han proporcionado evidencia de la existencia de al menos dos clases de exportadores de GSH de membrana plasmática ( Ballatori et al., 2005 , 2008 ). Primero, un papel para las proteínas MRP en el transporte de GSH fue indicado por estudios en la levadura S. cerevisiae ( Rebbeor et al., 1998a , 1998b , 2002 ), por estudios en membranas de hepatocitos del hígado del patín ( Rebbeor et al. ., 2000 ), y mediante estudios que utilizan vesículas de membrana aisladas de levadura y de hígado de rata ( Rebbeor et al., 2002 ). Los estudios en levadura proporcionaron la primera evidencia directa del transporte de GSH de baja afinidad dependiente de ATP en cualquier tipo de célula (Rebbeor et al., 1998a ), y demostraron que este transporte de GSH dependiente de ATP en levaduras está mediado por Ycf1p, el ortólogo de levadura de MRP1 y MRP2 de mamíferos ( Rebbeor et al., 1998b ). Debido a que Ycf1p es estructural y funcionalmente homólogo a MRP1 y MRP2, estos datos indicaron que el flujo de salida de GSH de las células de mamíferos podría estar mediado en parte por estas proteínas. En segundo lugar, se demostró que la rata Oatp1, el transportador de absorción de soluto orgánico sinusoidal, funciona como un intercambiador de soluto orgánico / GSH ( Li et al., 1998) y, por lo tanto, podría contribuir a la liberación de GSH de las células. Sin embargo, los estudios con otros miembros de la familia de proteínas OATP no han podido identificar un requisito de GSH comparable para el transporte. Por ejemplo, estudios recientes con dos OATP humanos no demostraron ningún papel de GSH en su mecanismo de transporte ( Mahagita et al., 2007 ).
Los estudios en vesículas de membrana canalicular del hígado de rata proporcionaron la primera evidencia directa del transporte de GSH en Mrp2 ( Rebbeor et al., 2002 ). Rebbeor y col. (2002) demostraron que la incapacidad para detectar el transporte de GSH dependiente de ATP en estudios previos con vesículas de membrana plasmática de mamíferos se debió en parte al efecto inhibidor del ditiotreitol (DTT) en el transporte mediado por Mrp2. La DTT es un agente reductor que normalmente se agrega para prevenir la oxidación de GSH en los estudios de vesículas de membrana. Debido a que todos los estudios previos del transporte de GSH utilizaron altas concentraciones de DTT u otros agentes reductores, probablemente subestimaron las tasas de transporte de GSH. Por lo tanto, estos resultados demuestran que tanto Mrp2 de rata como su ortólogo de levadura, Ycf1p, pueden transportar GSH mediante un mecanismo de baja afinidad dependiente de ATP (Rebbeor et al., 2002 ).
El soporte para un papel de Mrp1 y Mrp2 en la exportación de GSH es proporcionado por estudios en modelos de mouse knockout. Las mediciones de los niveles de GSH en tejidos de ratones deficientes en Mrp1, Mrp2 o Cftr , revelan que estos ratones han alterado los niveles de GSH ( Lorico et al., 1997 ; Velsor et al., 2001 ; Chu et al., 2006 ; Kruh et al., 2007 ). Lorico y col. (1997) informaron que los niveles de GSH son entre un 20 y un 40% más altos en los tejidos de ratones Mrp1 - / - que normalmente expresan niveles relativamente altos de esta proteína. En ratas y ratones con deficiencia de Mrp2, los niveles de GSH hepático aumentan aproximadamente 2 veces (por ejemplo, Ballatori et al., 1995 ;Chu et al., 2006 ). En ratones Cftr - / - , la concentración de GSH en el líquido del revestimiento epitelial es ligeramente menor que la de los ratones de tipo salvaje, pero la concentración de GSH en el tejido pulmonar no se ve afectada ( Velsor et al., 2001 ). Debido a que Mrp1 se expresa en todos los tejidos, puede desempeñar un papel ubicuo en la exportación de GSH desde todas las células, mientras que Mrp2 se expresa en solo unos pocos tipos de células y, por lo tanto, solo puede contribuir a la exportación de GSH en esas células ( Ballatori et al., 2008 )
Tabla 3
Proteínas relacionadas con GSH y sus posibles asociaciones de enfermedades
Proteínas relacionadas con GSHAsociación de enfermedades
Enzimas:
γ-Glutamilcisteína ligasaAnemia hemolítica, infarto de miocardio, esquizofrenia, síntomas neurológicos, EPOC
Glutatión sintetasaAnemia hemolítica, acidosis metabólica, disfunción del SNC.
γ-Glutamil transpeptidasaGlutatión, aterosclerosis
DipeptidasaSíntomas neurológicos
γ-Glutamil ciclotransferasa(ninguna)
5-oxoprolinasaSíntomas neurológicos, hipoglucemia, cálculos renales.
N- acetiltransferasasSensibilidad a las drogas
Glutatión S -transferasasCáncer, EPOC, enfermedad cardiovascular, hipoacusia relacionada con la edad
Glutatión reductasaAnemia hemolítica, enfermedad cardiovascular
Glutatión peroxidasasOsteoporosis, enfisema, enfermedad cardiovascular.
PeroxiredoxinasAnemia hemolítica, cáncer, enfermedad cardiovascular, disfunción del SNC
GlutaredoxinaEnfermedad cardiovascular
TiorredoxinaEnfermedad cardiovascular
Transportadores:
MRP1 / ABCC1Respuesta inflamatoria reducida, resistencia a múltiples fármacos
Una deficiencia en la primera enzima limitante de la velocidad en la síntesis de GSH, a saber, la γ-glutamilcisteína ligasa, es una enfermedad autosómica recesiva muy rara caracterizada por anemia hemolítica y, en algunos casos, por síntomas neurológicos. Algunos pacientes presentan degeneración espinocerebelosa, neuropatía periférica, miopatía y aminoaciduria (Njalsson y Norgren, 2005; Ristoff y Larsson, 2007 ). La γ-glutamilcisteína ligasa es un dímero que consiste en una subunidad pesada (catalítica) y ligera (modificador). Aunque la subunidad pesada por sí sola puede catalizar la formación de L-γ-glutamil-L-cisteína, la unión con la subunidad modificadora mejora la actividad enzimática al reducir el Km para glutamato y ATP, y aumentar el Kipara la inhibición de GSH. Se han creado ratones knockout para las subunidades catalizadoras y modificadoras ( Dalton et al., 2000 ; Shi et al., 2000 ; Yang et al., 2002 ). Los ratones que carecen de la subunidad modificadora ( ratones Gclm - / - ) son viables y fértiles y no tienen un fenotipo manifiesto en condiciones basales; sin embargo, los niveles de GSH en hígado, pulmón, páncreas, eritrocitos y plasma de estos animales son del 9 al 16% de los compañeros de camada de tipo salvaje, y los niveles de cisteína son del 9, 35 y 40% de los de ratones de tipo salvaje en riñón, páncreas , y plasma, respectivamente, pero no cambian en el hígado y los eritrocitos ( Yang et al., 2002 ). De importancia, la disminución de GSH combinada con la disminución de la actividad ligasa de γ-glutamilcisteína en estos animales, hace queGclm - / - fibroblastos fetales sorprendentemente más sensibles a los oxidantes químicos ( Yang et al., 2002 ). A diferencia de los ratones que carecen de la subunidad reguladora de la γ-glutamilcisteína ligasa, los embriones de ratón que carecen de la subunidad catalítica no se gastrulan y mueren antes del día 8.5 de gestación ( Dalton et al., 2000 ; Shi et al., 2000 ).
El segundo paso de la biosíntesis de GSH es catalizado por la glutatión sintetasa, que agrega glicina al dipéptido de γ-glutamilcisteína preformado. La deficiencia de glutatión sintetasa es el trastorno más frecuentemente reconocido del metabolismo de GSH, aunque también es una enfermedad relativamente rara (Njalsson y Norgren, 2005; Ristoff y Larsson, 2007) Los pacientes con deficiencia leve de glutatión sintetasa a menudo tienen mutaciones que afectan la estabilidad de la enzima, y estos pacientes muestran una anemia hemolítica compensada. Los pacientes con deficiencia moderada a severa de glutatión sintetasa típicamente tienen mutaciones que afectan las propiedades catalíticas de la enzima. La deficiencia moderada de glutatión sintetasa conduce a anemia hemolítica y acidosis metabólica, mientras que los pacientes con una deficiencia más severa también desarrollan 5-oxoprolinuria, infecciones bacterianas recurrentes y disfunción progresiva del sistema nervioso central, incluyendo retraso mental y trastornos funcionales motores. Algunas personas también tienen pigmentaciones retinianas y electrorretinogramas patológicos. No hay cura para esta enfermedad.Los pacientes reciben vitaminas C y E para aumentar los niveles de antioxidantes y bicarbonato para corregir la acidosis metabólica. La acidosis metabólica y la 5-oxoprolinuria en estos pacientes se explican por la disminución de la inhibición por retroalimentación de la γ-glutamilcisteína ligasa resultante de los niveles más bajos de GSH. En estas condiciones, la enzima γ-glutamilcisteína ligasa continúa produciendo grandes cantidades de γ-glutamilcisteína, que es convertida por la γ-glutamil ciclotransferasa en 5-oxoprolina (que se convierte por γ-glutamil ciclotransferasa en 5-oxoprolina (que se convierte por γ-glutamil ciclotransferasa en 5-oxoprolina (Figura 1C) La sobreproducción de 5-oxoprolina excede la capacidad de su enzima degradante, la 5-oxoprolinasa y la 5-oxoprolina, por lo tanto, se acumula en los fluidos corporales y se excreta en la orina.
La tercera enzima del ciclo γ-glutamil es la ectoenzima γ-glutamil transpeptidasa, que escinde el residuo de glutamato de las moléculas que contienen GSH y GSH (Figura 1C) Se ha informado de seres humanos con deficiencia de γ-glutamil transpeptidasa, y estos individuos muestran una mayor concentración de glutatión en la orina (glutatión) y en el plasma sanguíneo, y algunos muestran anormalidades del sistema nervioso central. La glutatiónuria se debe a su incapacidad para descomponer el GSH que se filtra y secreta en el líquido tubular renal. Se han generado ratones con deficiencia de γ-glutamil transpeptidasa, y estos animales exhiben glutatión, glutatión, falla de crecimiento, cataratas, letargo, vida útil acortada e infertilidad ( Lieberman et al., 1996 ; Kumar et al., 2000 ). No se ha aprobado ninguna terapia para uso humano, aunque la suplementación continua con N-acetilcisteína restaura la fertilidad y extiende la vida útil de los ratones knockout (Lieberman et al., 1996 ; Kumar et al., 2000 ).
La hidrólisis de cisteinilglicina y de S -conjugados de cisteinilglicina formados a partir de la degradación mediada por γ-glutamil transpeptidasa de conjugados GSH y GS, respectivamente, está mediada por diversas actividades de dipeptidasa, incluida la ectoenzima aminopeptidasa N unida a la membrana plasmática.Figura 1C) y leucil aminopeptidasa citosólica (EC 3.4.11.1; Jösch et al., 2003 ). Hasta la fecha, solo un paciente ha sido identificado con una sospecha de deficiencia en la actividad de la dipeptidasa (Njalsson y Norgren, 2005; Ristoff y Larsson, 2007 ). Este era un niño de 15 años que presentaba retraso mental, discapacidad motora leve y sordera parcial ( Mayatepek et al., 2005 ). Las investigaciones bioquímicas mostraron un nivel normal de cisteinilglicina en plasma, un perfil urinario anormal con una excreción notablemente aumentada de cisteinilglicina y leucotrieno D4 (LTD4). La concentración urinaria de LTD4, que generalmente no es detectable en la orina, aumentó mucho, mientras que LTE4, el principal metabolito urinario de leucotrienos en humanos, estaba ausente en este paciente.
La 5-oxoprolinasa cataliza la apertura del anillo de 5-oxoprolina para producir glutamato (Figura 1D) La deficiencia de 5-oxoprolinasa es una enfermedad autosómica recesiva muy rara caracterizada por 5-oxoprolinuria y una presentación clínica muy heterogénea, que incluye formación de cálculos renales, enterocolitis, retraso mental, hipoglucemia neonatal, anemia microcítica y microcefalia (Njalsson y Norgren, 2005; Ristoff y Larsson, 2007 ).
Enfermedades neurodegenerativas
Como se señaló anteriormente, se ha observado disfunción del sistema nervioso central en todas las enfermedades relacionadas con errores innatos del metabolismo de GSH, lo que sugiere que el cerebro es particularmente susceptible a alteraciones en la homeostasis de GSH. Se desconoce el motivo de esta sensibilidad, aunque se pueden considerar dos posibilidades generales, a saber, la alta susceptibilidad del cerebro al estrés oxidativo debido a su alto consumo de oxígeno, y la posibilidad de que GSH sea un neuromodulador o neurotransmisor y, por lo tanto, puede ser esencial para actividades del sistema nervioso central.
Tenga en cuenta que aunque el cerebro representa solo alrededor del 2% del peso corporal en humanos, consume alrededor del 20% del oxígeno total, y las mitocondrias utilizan alrededor del 90% de este oxígeno para producir ATP. Desafortunadamente, parte del oxígeno consumido en las mitocondrias se convierte en especies reactivas de oxígeno en lugar de agua ( Richter, 1992) Bajo ciertos estados patológicos de disfunción mitocondrial, esta tasa de conversión a especies reactivas de oxígeno puede aumentar como resultado de la fuga de electrones de la cadena de transporte de electrones y la posterior reducción de oxígeno a superóxido. De acuerdo con este mecanismo general, el estrés oxidativo es uno de los principales mecanismos patogénicos propuestos para los trastornos neurodegenerativos en los que se han informado defectos mitocondriales, incluidas las enfermedades de Parkinson, Huntington y Alzheimer. La peroxidación lipídica y el daño al ADN y otras proteínas se han detectado en muestras de dichos pacientes.
Al igual que en otros tejidos, el cerebro está equipado con mecanismos de defensa contra las especies reactivas de oxígeno, incluidas las enzimas antioxidantes superóxido dismutasa, glutatión peroxidasa y catalasa, junto con GSH: sin embargo, los niveles de GSH en el cerebro son bajos en comparación con otros tejidos y son células -tipo dependiente. Por ejemplo, las concentraciones de GSH en las neuronas (~ 2.5 mM) son relativamente bajas en comparación con los astrocitos (~ 3.8 mM) u otros tipos de células ( Bolanos et al., 1995 ; Rice et al., 1998 ), probablemente como resultado de La actividad específica más baja para la γ-glutamilcisteína ligasa en neuronas ( Gegg et al., 2003) Esta diferencia puede explicar parte de la mayor sensibilidad inherente de las neuronas a muchos insultos tóxicos. Curiosamente, los astrocitos pueden compartir GSH con neuronas vecinas al liberar GSH en el espacio extracelular ( Hirrlinger et al., 2002c ). Este paso de exportación parece estar mediado en parte por MRP1. A partir de este microambiente extracelular compartido, el GSH es escindido por la γ-glutamil transpeptidasa en la membrana plasmática astrocítica para generar precursores para la síntesis neuronal de GSH. A diferencia de los astrocitos, las neuronas, las microglias y los oligodendrocitos no liberan fácilmente GSH ( Hirrlinger et al., 2002c ), y esto probablemente se explica por la expresión de bajo nivel de MRP1 en estos tipos de células ( Hirrlinger et al., 2002a) Por lo tanto, los astrocitos son los principales contribuyentes a los niveles extracelulares de GSH en el cerebro. Usando microdiálisis in vivo , se informaron niveles extracelulares de GSH de aproximadamente 2 µM para cerebro de rata, que son bajos en comparación con niveles en plasma sanguíneo de 5-20 µM ( Yang et al., 1994 ; Han et al., 1999 ). De acuerdo con un papel neuroprotector, se informan reducciones en los niveles de GSH en pacientes y modelos animales de diversos trastornos neurodegenerativos. Como se detalla a continuación, existe una creciente evidencia del papel de GSH en la patogénesis de la enfermedad de Parkinson, mientras que se han reportado resultados contradictorios para la enfermedad de Alzheimer.
La enfermedad de Alzheimer, caracterizada por alteraciones en la memoria y la cognición, es un trastorno neurodegenerativo progresivo que representa la forma más común de demencia en los ancianos. El aumento de la edad y las mutaciones genéticas son factores de riesgo para la enfermedad de Alzheimer, y solo alrededor del 5% de los casos de enfermedad de Alzheimer se heredan de forma autosómica dominante. Las mutaciones en los genes que codifican la proteína precursora amiloide o las proteínas procesadoras de proteína precursora amiloide presenilina-1 o presenilina-2 constituyen las formas familiares de la enfermedad de Alzheimer. Los casos restantes de la enfermedad de Alzheimer son esporádicos con etiología desconocida. Tanto en las formas familiares como esporádicas de la enfermedad de Alzheimer, la neuropatología se caracteriza por la pérdida de neuronas piramidales en el hipocampo y la corteza, así como neuronas colinérgicas en el cerebro anterior basal.Las deposiciones de placas amiloides extracelulares y ovillos neurofibrilares intracelulares en el hipocampo y la corteza son características sorprendentes de la enfermedad de Alzheimer. El estrés oxidativo se propone como un mecanismo patogénico principal en la enfermedad de Alzheimer (Liu et al., 2004 ; Viña y col. 2004 ). Los pacientes de Alzheimer muestran un aumento de los marcadores sanguíneos de estrés oxidativo, incluido un aumento de la oxidación de los glóbulos rojos de la sangre, y esto se correlaciona con el estado cognitivo de los pacientes ( Viña et al. 2004 ). Por otro lado, las mediciones de los niveles de GSH en cerebros de pacientes con Alzheimer han arrojado resultados contradictorios. Se informó que los niveles de GSH eran más bajos en la sustancia innominada y la corteza cingulada en muestras de cerebro de pacientes con enfermedad de Alzheimer por Gu et al. (1998) , mientras que Perry et al. (1987) no pudieron detectar cambios en los niveles de GSH en estas mismas regiones del cerebro, y Adams, Jr. et al. (1991)encontró niveles más altos de GSH en el hipocampo de muestras post mortem de pacientes con enfermedad de Alzheimer. Las variables como las diferencias en las técnicas y la calidad de las muestras post mortem entre laboratorios pueden explicar estas discrepancias. En un intento por evitar el uso de muestras post mortem, Liu et al. (2005) recolectaron glóbulos rojos frescos y evaluaron su contenido de GSH. Curiosamente, detectan niveles significativamente más bajos de GSH en pacientes masculinos, pero no pacientes femeninos con enfermedad de Alzheimer ( Liu et al., 2005 ), lo que complica la interpretación de la participación de GSH en la patogénesis de la enfermedad de Alzheimer.
La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más común. La enfermedad de Parkinson se caracteriza por la pérdida de neuronas dopaminérgicas en la sustancia negra compacta, lo que lleva a una pérdida de dopamina en el cuerpo estriado ( Dauer et al., 2003 ). Aunque la enfermedad de Parkinson se ha descrito durante más de 200 años, la base de la enfermedad sigue siendo en gran medida desconocida. Recientemente se han identificado cinco genes como posibles contribuyentes (a saber, SNCA, Parkin, DJ1, PINK1, LRRK2); sin embargo, estas mutaciones genéticas representan solo una pequeña fracción (<10%) de los pacientes con enfermedad de Parkinson.
Los tóxicos ambientales han tenido la hipótesis de jugar un papel dominante en los casos esporádicos de la enfermedad de Parkinson y el estrés oxidativo se ha propuesto como un mecanismo principal de muerte celular en la enfermedad de Parkinson ( Beal, 2002 ; Jenner, 2003 ). En modelos animales experimentales de la enfermedad, las fuentes de estrés oxidativo provienen tanto de los compartimentos intracelulares como extracelulares ( Tieu et al., 2003) Extracelularmente, el superóxido puede ser liberado por la NADPH-oxidasa activada en microglia, y este superóxido extracelular puede reaccionar con el óxido nítrico generado por la óxido nítrico sintasa neuronal (nNOS) y el óxido nítrico sintasa inducible por microgía (iNOS) para producir el peroxinitrito más estable y reactivo. Intracelularmente, el superóxido se puede generar a través de las interrupciones de la respiración mitocondrial. Relevante para este último mecanismo patogénico, se ha informado una reducción en la actividad del complejo mitocondrial I en muestras de pacientes con enfermedad de Parkinson ( Parker, Jr. et al., 1989 ; Schapira et al., 1990 ).
El papel del estrés oxidativo en la enfermedad de Parkinson se destaca aún más por la observación de que el contenido de GSH es significativamente menor (~ 40%) en la sustancia negra de los pacientes con enfermedad de Parkinson ( Sian et al., 1994 ). A nivel celular, las neuronas dopaminérgicas nigrales sobrevivientes muestran una pérdida significativa de GSH ( Pearce et al., 1997 ). Aunque el mecanismo de esta disminución no se ha establecido, es poco probable que sea secundario a la pérdida neuronal o al tratamiento farmacológico. Debido a que la región nigrostriatal es rica en dopamina, es posible que la dopamina oxidada cause el agotamiento de GSH, y de hecho, la inyección intraestriatal de dopamina causa una disminución significativa en los niveles de GSH ( Rabinovic y Hastings, 1998), probablemente a través de las interacciones de dopamina quinona con GSH y / o cisteína ( Spencer et al., 1998 ; Hirrlinger et al., 2002b ). En modelos genéticos de la enfermedad de Parkinson, los cultivos de astrocitos de ratones knock-out de Parkin tienen niveles más bajos de GSH que los de animales de tipo salvaje ( Solano et al., 2008 ). La importancia del agotamiento de GSH se demuestra aún más por la muerte de células dopaminérgicas en modelos de Drosophila con mutación de Parkin ( Whitworth et al., 2005 ) o con sobreexpresión de α -sinucleína ( Trinh et al., 2008 )
Curiosamente, el agotamiento de GSH también se ha informado en estudios recientes destinados a inhibir la actividad del complejo mitocondrial I a través de la nitrosilación S de esta subunidad de la cadena de transporte de electrones ( Burwell et al., 2006 ; Chinta et al., 2007 ). Sin embargo, este efecto del agotamiento de GSH es poco probable que sea la causa principal del defecto mitocondrial en pacientes con enfermedad de Parkinson, ya que la deficiencia del complejo I está muy extendida en varios tejidos ( Parker, Jr. et al., 1989 ; Schapira et al., 1990 ), mientras que La pérdida de GSH solo se detecta en la sustancia negra ( Sian et al., 1994) Además, el agotamiento de GSH solo puede no ser suficiente para inducir la muerte celular porque la butionina sulfoximina, un inhibidor de la γ-glutamilcisteína ligasa, no mata las células dopaminérgicas ( Toffa et al., 1997 ). Sin embargo, el agotamiento de GSH aumenta la muerte celular cuando se inhibe la función mitocondrial ( Zeevalk et al., 1998 ). Claramente, los efectos son bastante complejos y probablemente involucren daño macromolecular inducido por el estrés oxidativo y la interrupción de la señalización redox. Sin embargo, la pérdida de GSH en la sustancia negra puede explicar, al menos en parte, la aparente discrepancia entre la deficiencia generalizada del complejo I en diferentes tejidos versus la muerte celular selectiva en las células dopaminérgicas nigrales.
Otra posibilidad más especulativa para la sensibilidad del sistema nervioso central al agotamiento de GSH es que GSH puede funcionar como neuromodulador o neurotransmisor y, por lo tanto, cualquier cambio en los niveles de GSH, las tasas de renovación o el estado de oxidación afectaría negativamente la actividad del sistema nervioso central ( Cobb et al., 1982 ; Guo et al., 1992 ; Janaky et al., 1999, 2000, 2007; Oja et al., 2000) Tenga en cuenta que GSH está formado por tres aminoácidos neuroactivos (glutamato, cisteína y glicina), y por lo tanto este péptido puede verse como una forma de almacenamiento o precursor de estas moléculas biológicamente activas. El glutamato y la glicina son neurotransmisores excitadores e inhibidores conocidos, respectivamente, pero la cisteína también tiene un efecto excitador en la clase de receptores de glutamato N-metil-D-aspartato (NMDA). La degradación de GSH extracelular por la γ-glutamil transpeptidasa libera glutamato (y cisteinilglicina) en sitios específicos dentro del cerebro, y la posterior hidrólisis mediada por peptidasa de cisteinilglicina libera cisteína y glicina. Además de funcionar como una fuente de aminoácidos neuroactivos, existe una creciente evidencia de que el GSH es un neurotransmisor o neuromodulador ( Cobb et al., 1982 ;Guo et al., 1992 ; Janaky et al., 1999, 2000, 2007; Leslie y col., 1992 ; Ogita et al., 1995 ; Oja et al., 2000 ). Janaky y col. (2000) identificaron supuestos sitios de unión de GSH en membranas sinápticas corticales cerebrales de cerdo y sugirieron la presencia de un receptor de glutatión, aunque esto aún no se ha establecido firmemente.
Sin embargo, existe una fuerte evidencia de que GSH es tanto un ligando como un modulador del receptor NMDA ( Janáky et al., 1999 ; Leslie et al., 1992 ; Ogita et al., 1995 ; Oja et al., 2000 ), y por lo tanto puede estar involucrado en enfermedades relacionadas con este receptor, incluida la esquizofrenia ( Do et al., 2000 ; Jacobsen et al., 2005) Curiosamente, Matsuzawa et al. (2008) informaron recientemente que aunque los niveles generales de GSH en la corteza frontal medial posterior de los pacientes con esquizofrenia no son diferentes de los de los controles normales, hubo una correlación significativa entre los niveles de GSH y la gravedad de los síntomas en los pacientes. Matsuzawa et al. (2008) sugirieron que las terapias destinadas a aumentar los niveles de GSH en las regiones cerebrales afectadas pueden beneficiar a los pacientes esquizofrénicos. En este sentido, Lavoie et al. (2008) demostraron recientemente que la administración de N- acetilcisteína mejora la negatividad del desajuste en pacientes con esquizofrenia, aunque aún no se ha identificado el mecanismo por el cual la N- acetilcisteína ejerció sus efectos.
El papel crítico desempeñado por GSH en la supervivencia neuronal proporciona una fuerte justificación para el desarrollo de terapias destinadas a restaurar los niveles de GSH cerebral ( Zeevalk et al., 2008 ). Sin embargo, hasta la fecha, estos enfoques generalmente han tenido poco éxito, ya que existen obstáculos importantes para el suministro de GSH a las neuronas objetivo, incluida la ausencia de transportadores selectivos de absorción de GSH, la relativa impermeabilidad de la barrera hematoencefálica y el hecho esa cisteína, que limita la velocidad de síntesis de GSH, puede ser citotóxica cuando se administra a dosis altas. Por ejemplo, los intentos de administrar GSH sistémicamente a través de bombas mini-osmóticas (50 mg / kg / día) no lograron elevar los niveles de GSH en el cerebro de la rata ( Zeevalk et al., 2007 ). Pinnen y col. (2007)intentó administrar GSH a las neuronas dopaminérgicas uniendo covalentemente GSH a L-dopa, un precursor de la dopamina y un tratamiento fundamental de la enfermedad de Parkinson ( Pinnen et al., 2007 ); sin embargo, debido a que estos derivados se eliminan rápidamente del plasma sanguíneo, no pueden aumentar el GSH neuronal. Como la cisteína puede cruzar la barrera hematoencefálica, este aminoácido representa un enfoque alternativo para aumentar el GSH; sin embargo, la excitotoxicidad potencial inducida por altas concentraciones de cisteína plantea una limitación significativa a esta estrategia. En un estudio reciente, Trinh et al. (2008) tomó un enfoque diferente: usar DrosophilaLos modelos genéticos de la enfermedad de Parkinson fueron capaces de atenuar la pérdida neuronal mediante el uso de los productos químicos sulforafano y disulfuro de alilo para inducir enzimas biosintéticas GSH. Sin embargo, no se sabe si estos químicos realmente indujeron estas enzimas y aumentaron los niveles de GSH en el cerebro, ni si producirían los mismos efectos en los modelos animales vertebrados.
En general, la creciente evidencia apoya el efecto protector de GSH en los trastornos neurodegenativos, y especialmente en la enfermedad de Parkinson; sin embargo, aún no se han identificado terapias efectivas que puedan mejorar los niveles de GSH en las regiones cerebrales afectadas. Las estrategias adicionales que podrían explorarse para mejorar los niveles de GSH en el cerebro incluyen la administración de derivados o precursores de GSH lipofílicos, la administración de fármacos para inducir enzimas biosintéticas de GSH o para inhibir la transpeptidasa de γ-glutamil (y así inhibir la degradación de GSH), y / o la administración de inhibidores de la exportación de GSH. Sin embargo, dado que GSH desempeña múltiples funciones críticas en todas las células del cuerpo, cada uno de estos enfoques potenciales tiene muchas limitaciones y es probable que tenga muchas consecuencias no deseadas, a menos que sean selectivamente dirigidos y rigurosamente controlados.
Otras enfermedades del envejecimiento.
Además de las enfermedades neurológicas discutidas anteriormente, GSH está fuertemente asociado con otras patologías relacionadas con la edad ( Samiec et al., 1998 ). A medida que los individuos envejecen, hay una disminución gradual de los niveles de GSH y de las defensas antioxidantes generales, así como una disminución en la capacidad de estos sistemas para ser inducidos por estímulos exógenos ( Knight, 2000 ; Lang et al., 1992 ; Rikans et al. ., 1997 ; Viveros et al., 2007 ), y esta disminución se asocia con una mayor incidencia de enfermedades crónicas relacionadas con la edad ( Lang et al., 2000 ). Aunque se desconocen la conexión exacta y los mecanismos para estos eventos, la disminución de la actividad de la γ-glutamilcisteína ligasa y la glutatión sintetasa (Sethna et al., 1982 ), γ-cistationasa ( Sastre et al., 2005 ) y glutatión reductasa ( Holleschau et al., 1994 ; Katakura et al., 2004 ) se consideran factores contribuyentes.
El GSH normalmente está presente en altos niveles en la lente ocular, la córnea, el humor acuoso y la retina, donde desempeña múltiples funciones, incluido el mantenimiento de la hidratación normal del tejido y la transparencia de la lente, y la protección contra el daño oxidativo. Los niveles de GSH disminuyen en los ojos humanos con la edad ( Harding et al., 1970 ), y la disminución de los niveles de GSH se ha asociado con varios trastornos oculares relacionados con la edad, incluidas las cataratas nucleares relacionadas con la edad ( Pau et al., 1982 ; Bhat et al. ., 1991 ), glaucoma ( Moreno et al., 2004 ) y degeneración macular ( Sternberg et al., 1993 ).
La oxidación es el sello distintivo de las cataratas nucleares relacionadas con la edad. La oxidación de los residuos de metionina y cisteína, y la pérdida de grupos tiol en proteínas estructurales aumentan progresivamente a medida que empeoran las cataratas. Debido a que la lente depende de un estado equilibrado de tiol redox para mantener una transparencia completa, los altos niveles de GSH son importantes para proteger los grupos de proteínas tiol contra especies reactivas de oxígeno. En la región central de las lentes con cataratas, un aumento en GSSG conduce a una relación desequilibrada GSH / GSSG y amplias modificaciones de proteínas nucleares, que incluyen oxidación, insolubilización y reticulación ( David et al., 1984 ), junto con una pérdida de GSH ( Calvin et al., 1986) La retina es especialmente susceptible al estrés oxidativo debido a su alto consumo de oxígeno y exposición a la luz. Del mismo modo, GSH es un antioxidante importante en la retina, y el agotamiento de GSH se ha asociado con la etiología de dos retinopatías principales, la degeneración macular relacionada con la edad y el glaucoma. La degeneración macular relacionada con la edad es una enfermedad multifactorial compleja que afecta la región central de la retina. Aunque no se conoce la etiología exacta, el daño oxidativo del epitelio pigmentario de la retina se ha implicado en la patogénesis de esta enfermedad ( Young et al. 1987 , 1988 ). En pacientes con degeneración macular exudativa relacionada con la edad, la GSH en plasma y el contenido total de tiol disminuyen significativamente ( Coral et al., 2006) La deficiencia de la síntesis de GSH ( Sternberg et al., 1993 ) y el reciclaje de GSH ( Cohen et al., 1994 ) en las células epiteliales de la retina pueden ser responsables de la disminución. Si bien el aumento de la presión intraocular es un factor de riesgo importante para el glaucoma, la pérdida apoptótica progresiva de las células ganglionares de la retina es la razón principal de la pérdida de visión en todos los casos de glaucoma ( Kerrigan-Baumrind et al., 2000 ). La apoptosis de las células ganglionares de la retina puede ser inducida por el agotamiento de GSH, que implica la producción de especies endógenas reactivas al oxígeno ( Maher et al., 2005 ). Los niveles retinianos de GSH disminuyen significativamente en el modelo experimental de glaucoma de rata ( Moreno et al., 2004) Como se ilustra arriba, los sistemas de defensa antioxidante comprometidos se asocian comúnmente con enfermedades oculares relacionadas con la edad y, por lo tanto, los suplementos antioxidantes se han convertido en una de las estrategias terapéuticas para prevenir o retrasar la aparición de trastornos oculares ( Head et al., 2001 ). Por ejemplo, los pacientes con degeneración macular relacionada con la edad se benefician de la administración de antioxidantes ( Moriarty-Craige et al., 2005 ).
La discapacidad auditiva es otra condición crónica común relacionada con la edad asociada con la producción de especies reactivas de oxígeno ( Knight, 2000 ; Seidman et al., 2002 ; Jiang et al., 2007 ). La pérdida auditiva relacionada con la edad se desarrolla antes y es más grave en ratones con deficiencia de superóxido dismutasa ( McFadden et al., 1999a , 1999b , 2001 ). Del mismo modo, la mutación dirigida del gen para la glutatión peroxidasa celular (Gpx1) aumenta la pérdida auditiva inducida por ruido en ratones ( Ohlemiller et al., 2000 ).
También se cree que el estrés oxidativo está involucrado en la patogénesis de la osteoporosis ( Isomura et al., 2004 ; Sanchez-Rodriguez et al., 2007 ). La osteoporosis posmenopáusica se caracteriza por la pérdida de masa ósea y el deterioro micro-arquitectónico, lo que resulta en una disminución de la competencia biomecánica y, en consecuencia, un mayor riesgo de fractura. En las mujeres osteoporóticas posmenopáusicas, la actividad osteoblástica se reduce constantemente a medida que aumenta la actividad osteoclástica, lo que indica que las especies reactivas de oxígeno juegan un papel importante en el metabolismo óseo ( Sontakke et al., 2002) La actividad glutatión peroxidasa y superóxido dismutasa es significativamente menor en mujeres osteoporóticas, lo que sugiere que las defensas antioxidantes comprometidas juegan un papel importante en el desarrollo de osteoporosis ( Maggio et al., 2003 ; Ozgocmen et al., 2007a , 2007b ). En ratones, la N-acetilcisteína estimula la diferenciación de osteoblastos en parte al aumentar la síntesis de GSH ( Jun et al., 2008 ). El suplemento dietético con N-acetilcisteína es capaz de bloquear completamente la pérdida ósea asociada con la ovariectomía en roedores ( Lean et al., 2003 ; Lee et al., 2005 ), y también muestra algunos efectos beneficiosos en la desaceleración de la resorción ósea en mujeres posmenopáusicas tempranas ( Sanders et al., 2007) Teniendo en cuenta estos hallazgos, sería interesante examinar si la terapia clínica con precursores de GSH o derivados o suplementos antioxidantes en mujeres posmenopáusicas tempranas tendría beneficios económicos y de salud significativos.
Cáncer
GSH también juega un papel importante en el desarrollo y el tratamiento del cáncer, y varias revisiones recientes han abordado este tema (por ejemplo, Balendiran et al., 2004 ; Estrela et al., 2006 ). Por lo tanto, aquí solo se presentará una breve discusión. Ahora está bien establecido que las especies reactivas de oxígeno y los productos químicos electrofílicos pueden dañar el ADN y que GSH puede proteger contra este tipo de daño ( Valko et al., 2007 ). GSH también puede desintoxicar directamente los carcinógenos a través del metabolismo de fase II y la posterior exportación de estos químicos desde la célula. Por otro lado, se observan niveles elevados de GSH en varios tipos de células cancerosas y tumores sólidos, y esto tiende a hacer que estas células y tejidos sean más resistentes a la quimioterapia ( Calvert et al., 1998 ;Balendiran et al., 2004 ; Estrela et al., 2006 ). Algunas células cancerosas también exhiben mayores actividades de γ-glutamilcisteína ligasa y γ-glutamil transpeptidasa, y una mayor expresión de las bombas de exportación MRP / ABCC transportadoras de GSH ( O'Brien y Tew, 1996 ; Estrela et al., 2006 ).
Las células cancerosas también tienden a ser más resistentes a la apoptosis, y aunque el mecanismo no se entiende bien, se ha propuesto un papel para GSH (Tabla 4) ( Estrela et al., 2006 ; Ballatori et al., 2008 ). Se cree que un entorno intracelular más reducido facilita la proliferación y reduce la apoptosis de las células tumorales ( Schafer y Buettner, 2001 ; Estrela et al., 2006 ). Los niveles de GSH pueden influir en el proceso apoptótico al afectar la activación de la caspasa y el factor de transcripción, la producción de ceramida, la señalización de tiol-redox y la externalización de fosfatidilserina ( Hammond et al., 2001 ; Ballatori et al., 2005 ). Los niveles de GSH también parecen estar influenciados por las proteínas antiapoptóticas de la familia Bcl-2. Inicialmente, se informó que el oncogén Bcl-2 tenía funciones antioxidantes basadas en el fenotipo deRatón deficiente en Bcl-2 y peroxidación lipídica reducida en células que sobreexpresan Bcl-2 ( Hockenbery et al., 1993 ; Veis et al., 1993 ; Hochman et al., 1998 ). Estas propiedades antioxidantes pueden estar relacionadas con la correlación entre niveles altos de Bcl-2 o Bcl-X L y niveles elevados de GSH intracelular ( Celli et al., 1998 ; McCullough et al., 2001 ; Ortega et al., 2003 ; Benlloch et al. ., 2005 ). El mecanismo por el cual la expresión de Bcl-2 altera los niveles intracelulares de GSH es desconocido y puede depender del tipo de célula, ya que no todas las células que sobreexpresan Bcl-2 tienen niveles elevados de GSH (Schor et al., 2000 ). Se ha informado que los niveles elevados de GSH intracelular son causados por un aumento en la γ-glutamilcisteína ligasa debido a la activación de NFkB ( Jang y Surh, 2004 ) y por una disminución en el flujo de salida de GSH ( Bojes et al., 1997 ; Meredith et al., 1998 ; Schor et al., 2000 ; Ortega et al., 2003 ; Benlloch et al., 2005 ). Además, también se ha sugerido que Bcl-2 puede actuar como prooxidante y aumentar las especies reactivas de oxígeno generadas por las mitocondrias, y por lo tanto, el aumento de GSH es en respuesta a las condiciones de estrés oxidativo ( Kowaltowski y Fiskum, 2005 )
Tabla 4
Correlación entre los niveles de GSH y la tasa de apoptosis en enfermedades humanas
Demasiada apoptosis:Niveles GSH
Trastornos neurodegenerativos.
Enfermedad de ParkinsonBajo
Enfermedad de AlzheimerBajo
Isquémico
Infarto de miocardioBajo
Inmune
SIDABajo
Artritis reumatoideBajo
Diabetes mellitus insulinodependienteBajo
Esclerosis múltipleBajo
Muy poca apoptosis:Niveles GSH
CáncerAlto
De Fadeel et al., 1999 y Pastore et al., 2003 .
Como se señaló anteriormente, un mayor contenido de GSH en algunas células cancerosas hace que estas células sean quimiorresistentes, que es un factor importante que limita la efectividad del tratamiento farmacológico ( Calvert et al., 1998 ). La sobreexpresión de glutatión S -transferasas específicas también puede afectar la quimiorresistencia, mientras que los polimorfismos que disminuyen la actividad de glutatión S -transferasa están asociados con un riesgo elevado de desarrollar ciertos tipos de cáncer ( Balendiran et al., 2004 ; Masella et al., 2005 ). Expresión elevada de glutatión S-transferasas combinadas con altos niveles de GSH pueden aumentar la tasa de conjugación y desintoxicación de los agentes de quimioterapia, reduciendo así su efectividad. Además, el aumento de los niveles de expresión de los transportadores MRP / ABCC puede contribuir a la quimiorresistencia. Casi todos los miembros de la familia de transportadores MRP / ABCC son conocidos por transportar conjugados GSH y / o GSH en sí, y por lo tanto probablemente estén involucrados en la quimiorresistencia ( Ballatori et al., 2005 , 2008 ; Conseil et al., 2005 ; Deeley et al. ., 2006 ). Se ha observado una expresión elevada de MRP1 en una variedad de tumores hematológicos y sólidos, y se encuentran niveles aumentados de expresión de otros transportadores de MRP en algunos tejidos cancerosos ( Leslie et al., 2005 ;Deeley et al., 2006 ). Además, los ratones deficientes en Mrp1 , Mrp2 y Mrp4 son más sensibles a ciertos agentes quimioterapéuticos, lo que indica que la familia de transportadores MRP / ABCC es importante en la quimiorresistencia ( Lorico et al., 1997 ; Wijnholds et al., 1998 ; Conseil et al. ., 2005 ; Vlaming et al., 2006 ).
Para sortear los efectos protectores de GSH en la quimioterapia contra el cáncer, se han empleado estrategias de reducción de GSH, como la inhibición de la L-butionina sulfoximina de la síntesis de GSH ( Calvert et al., 1998 ; Balendiran et al., 2004 ); sin embargo, existen posibles inconvenientes para este enfoque, incluidos los efectos nocivos en los tejidos no cancerosos ( Estrela et al., 2006 ).
Enfermedades pulmonares
Las principales enfermedades cardiovasculares asociadas con los desequilibrios redox son la hipertensión y la aterosclerosis. Según lo revisado por Leopold y Loscalzo (2005) , los polimorfismos en enzimas antioxidantes que incluyen glutatión peroxidasas y glutatión S- transferasas están asociadas con un mayor riesgo de enfermedad vascular debido al aumento en la acumulación de especies reactivas de oxígeno (Tabla 4) En particular, los polimorfismos de glutatión peroxidasa parecen aumentar el riesgo de desarrollar enfermedad coronaria, accidente cerebrovascular y trombosis venosa cerebral y los polimorfismos de glutatión S-transferasa están asociados con marcadores inflamatorios elevados y un mayor riesgo de enfermedad coronaria en los fumadores ( Leopold y Loscalzo, 2005 ). La tiorredoxina y la glutaredoxina también juegan un papel importante en la protección contra las enfermedades cardiovasculares al mejorar los efectos de las especies reactivas de oxígeno y la inflamación ( Berndt et al., 2007 ).
Estudios adicionales también han fortalecido la conexión entre GSH y las condiciones cardiovasculares. El desarrollo de la hipertensión se asocia con aumentos en las especies reactivas de oxígeno en las células endoteliales, y la angiotensina II puede inducir hipertensión y es un estímulo importante para la producción de especies reactivas de oxígeno. Widder y col. (2007) demostraron que la hipertensión inducida por angiotensina II se previene en ratones Mrp1 - / - , y esto se atribuyó al aumento de los niveles de GSH en las células endoteliales vasculares de estos ratones debido a la disminución de la exportación de GSH. Además, la hidrólisis de GSH a través de la γ-glutamil transpeptidasa puede estar asociada con la progresión de la aterosclerosis ( Emdin et al., 2005) Se ha sugerido que la presencia de γ-glutamil transpeptidasa en placas ateroscleróticas puede conducir a aumentos en las especies reactivas de oxígeno y oxidación de LDL a través de las reacciones de cisteinilglicina y hierro ( Emdin et al., 2005 ). Se ha especulado que estos eventos oxidativos pueden conducir a la liberación de las placas ateroscleróticas, aumentando así el riesgo de infarto de miocardio y accidente cerebrovascular ( Emdin et al., 2005 ). Una estrategia para atenuar la aterosclerosis y superar la oxidación de LDL y HDL puede ser administrar GSH atrapado en liposomas, como lo sugieren Rosenblat et al. (2007) . El GSH liposomal administrado a un modelo de ratón de aterosclerosis disminuyó los niveles de estrés oxidativo en el plasma sanguíneo y los macrófagos y la masa de colesterol en los macrófagosRosenblat et al., 2007 ).
Enfermedades cardiovasculares
También se cree que un desequilibrio en la homeostasis de GSH y en el estado tiol-redox contribuye a la etiología y / o progresión de las enfermedades pulmonares obstructivas crónicas (EPOC) como el enfisema y el asma, y a enfermedades pulmonares más agudas como el síndrome de dificultad respiratoria aguda (SDRA). Como en otros tejidos, la regulación de los niveles de GSH en el pulmón es bastante compleja ( Rahman, 2005 ; Kinnula et al., 2007 ). El factor de transcripción sensible redox Nrf2 desempeña un papel clave en la regulación de la expresión de numerosos genes antioxidantes, incluyendo la γ-glutamilcisteína ligasa, las glutatión S -transferasas y las glutatión peroxidasas ( Motohashi y Yamamoto, 2004 ; Rahman, 2005 ; Singh et al., 2006; Kinnula et al., 2007 ; Sibhatu et al., 2008 ), y una serie de factores ambientales y ocupacionales se cree que interrumpen esta regulación y contribuyen a la enfermedad pulmonar. Los niveles de Nrf2 y glutatión peroxidasa 2 se reducen en el tejido pulmonar de pacientes con enfisema, mientras que Keap1 aumenta ( Goven et al., 2008 ). En la EPOC, los antioxidantes regulados por Nrf2, incluido el GSH, disminuyen debido a la pérdida de DJ-1, una proteína que estabiliza la proteína Nrf2 al afectar su disociación de Keap1 ( Malhotra et al., 2008 ). Nrf2 también parece controlar el contenido de GSH a través de la regulación de la expresión de Mrp1, un exportador de GSH cuyos niveles disminuyen considerablemente en ausencia de Nrf2 ( Hayashi et al., 2003 ;Sibhatu et al., 2008 ). Además de la regulación de genes relacionados con GSH, algunas condiciones conducen a la formación de derivados de glutatión-aldehído no reducibles (p. Ej., Aductos de GSH con acroleína y crotonaldehído del humo del cigarrillo), agotando así el conjunto total de GSH disponible ( van der Toorn et al. ., 2007 ).
Los polimorfismos de las enzimas relacionadas con el glutatión también están asociados con un mayor riesgo de algunas enfermedades pulmonares. Como se resume por Bentley et al. (2008) , los polimorfismos en las enzimas γ-glutamilcisteína ligasa (subunidades catalizadoras y moduladoras) y glutatión S -transferasas (GST) M1 y P1 pueden contribuir a un mayor riesgo de EPOC. Estos polimorfismos en combinación con otros factores de riesgo como el tabaquismo y la baja ingesta de vitamina C probablemente contribuyen a la disminución de la función pulmonar ( Siedlinski et al., 2008 ). Las deficiencias de GSTM1 y GSTT1 también parecen aumentar el riesgo de asma infantil y otros efectos adversos para la salud del tabaquismo pasivo actual y en el útero ( Kabesch et al., 2004 ).
Debido a la importancia de GSH para las enfermedades pulmonares, muchos estudios han evaluado los efectos beneficiosos de los antioxidantes, incluida la N-acetilcisteína y el resveratrol de polifenol, en diversas patologías farmacológicas ( Rahman, 2005 ; Kode et al., 2008 ). Además, el GSH en sí mismo también puede ser una opción terapéutica. Estudios recientes sugieren que la administración directa de GSH o la inhibición de su enzima catabólica γ-glutamil transpeptidasa puede ser protectora contra la inducción del asma por las células epiteliales ( Lowry et al., 2008 ).
Fibrosis quística
GSH parece desempeñar un papel importante en la etiología, la progresión y el tratamiento potencial de la fibrosis quística, el trastorno hereditario más común en las poblaciones caucásicas ( Davies et al., 2007) En 1989, Riordan y sus colegas identificaron un canal de cloruro, el regulador de la conductancia transmembrana de la fibrosis quística (CFTR / ABCC7), que está mutado y no es funcional en la fibrosis quística. El CFTR contribuye al flujo de aniones en las células epiteliales de las vías respiratorias, el páncreas, los intestinos y las glándulas sudoríparas, lo que, cuando está ausente, conduce a insuficiencia pancreática, infertilidad masculina, inflamación crónica y la acumulación de moco en las vías respiratorias que aumenta las infecciones bacterianas en el pulmón . Las infecciones pulmonares recurrentes causan la mayoría de la morbilidad y mortalidad en la fibrosis quística. Es significativo que los pacientes con fibrosis quística hayan disminuido los niveles de GSH en el líquido del revestimiento epitelial pulmonar y el plasma sanguíneo; sin embargo, los niveles de GSH en el pulmón en sí parecen no verse afectados ( Roum et al., 1993) En individuos normales, el GSH se eleva 140 veces en el líquido del revestimiento epitelial en comparación con los niveles de plasma sanguíneo y tiene varias funciones, incluyendo romper los enlaces disulfuro para reducir la viscosidad del moco, afectar la hidratación del moco y regular la inflamación y la respuesta inmune ( Cantin et al. ., 1987 , 2007 ; Hudson, 2001 ). Dado que el CFTR está presente en el lado apical de las células epiteliales pulmonares y que puede transportar GSH, puede ser responsable del suministro de GSH al líquido del revestimiento epitelial; sin embargo, esto aún no se ha establecido (ver más abajo).
Los niveles de GSH de neutrófilos también pueden disminuir en pacientes con fibrosis quística, y esto podría contribuir al reclutamiento excesivo en las vías respiratorias, la función anormal y el aumento de la necrosis de neutrófilos observados en estos pacientes ( Tirouvanziam et al., 2006 ). De manera similar a los pacientes con fibrosis quística, el ratón con deficiencia de CFTR ha disminuido el contenido de GSH en el líquido del revestimiento epitelial; mientras que los niveles de GSH en el tejido pulmonar permanecen iguales que los ratones de tipo salvaje ( Velsor et al., 2001 ). GSH aumenta en el líquido del revestimiento epitelial después de la infección por Pseudomonas aeruginosa en ratones de tipo salvaje; sin embargo, este aumento después de la infección está ausente en ratones CFTR - / - ( Day et al., 2004) La incapacidad para aumentar el GSH en el líquido del revestimiento epitelial puede contribuir a la pobre respuesta a la infección observada en pacientes con fibrosis quística.
La forma exacta en que CFTR influye en el transporte de GSH todavía está en debate. CFTR es miembro de la familia de proteínas MRP / ABCC que incluye los MRP transportadores de GSH. Originalmente se demostró que el CFTR permitía el paso de GSH utilizando la técnica de fijación con parche ( Linsdell y Hanrahan, 1998 ) y más recientemente, se ha demostrado el transporte directo de GSH en CFTR en experimentos con vesículas de membrana y proteoliposomas ( Kogan et al., 2003 ). Curiosamente, GSH parece inhibir la actividad CFTR ATPasa ( Kogan et al., 2001 ), y esta inhibición puede alterar las propiedades de CFTR de modo que ahora favorece el flujo de GSH sobre el flujo de cloruro ( Kogan et al., 2003) Aunque se ha demostrado que CFTR transporta GSH en sistemas artificiales, si esto ocurre fisiológicamente o no, aún es controvertido. Las células de pacientes con fibrosis quística que carecen de CFTR funcional aún transportan GSH (Gao et al., 1999), aunque a una velocidad significativamente más lenta. Cuando el transporte de cloruro se restaura a estas células por un canal peptídico artificial que no puede transportar o conducir el GSH por sí mismo, el transporte de GSH aumenta a una velocidad normal ( Gao et al., 2001 ). Además, el ARNm para MRP1 , un transportador conocido de GSH, disminuye en las células ciliadas nasales con CFTR mutado, y disminuye aún más en las células más comprometidas en la conductancia del cloruro basal ( Hurbain et al., 2003) Por lo tanto, CFTR puede no conducir GSH, pero puede regular su transporte indirectamente a través del transporte de cloruro. Además, el CFTR interactúa con el canal de cloruro rectificador externo, el canal de potasio medular externo renal y el canal de sodio epitelial y es necesario para su correcto funcionamiento ( Schwiebert et al., 1999 ), y es posible que el CFTR también interactúe con los transportadores MRP u otras proteínas de transporte GSH. En este sentido, se ha demostrado que CFTR se asocia funcional y físicamente con MRP4, un transportador de AMPc que puede modular la actividad de CFTR alterando los niveles de AMPc ( Li et al., 2007 ). MRP4 también es un supuesto transportador de GSH, y aunque no fue examinado por Li et al., (2007), es posible que el transporte GSH pueda verse afectado por esta interacción.
Las vías respiratorias de fibrosis quística no solo están expuestas a la carga normal de oxidantes ambientales por inhalación, sino que también están expuestas a oxidantes debido al aumento de la inflamación y las infecciones presentes en los pulmones. Combinado con bajos niveles de GSH en el líquido de revestimiento epitelial y neutrófilos / plasma sanguíneo, el estrés oxidativo en la fibrosis quística aumenta. Aumentar o restaurar los niveles normales de GSH en pacientes con fibrosis quística tiene el potencial de contrarrestar estas condiciones de estrés oxidativo. La GSH inhalada aumenta moderadamente los niveles de GSH del fluido de revestimiento epitelial sin causar un aumento sistémico en la GSH ( Roum et al., 1999 ; Buhl et al., 1990 ). Algunos estudios clínicos han evaluado las mejoras de la función pulmonar debido a la GSH inhalada en pacientes con fibrosis quística con éxito modesto ( Griese et al., 2004; Bishop et al., 2005 ). Los tratamientos son bien tolerados por los pacientes; Sin embargo, una preocupación es que GSSG aumenta después del tratamiento y puede tener efectos negativos sobre el estado redox ( Roum et al., 1999 ). Además, el GSH inhalado puede causar broncoconstricción potencialmente mortal en pacientes sensibles y aquellos que tienen asma, particularmente si el pH de las soluciones de GSH no se ajusta antes de su administración ( Marrades et al., 1997 ; Prousky, 2008 ).
La N-acetilcisteína se ha utilizado como agente mucolítico en la fibrosis quística durante décadas, aunque los beneficios reales de la N-acetilcisteína para mejorar la función pulmonar en la fibrosis quística todavía se están debatiendo ( Duijvestijn y Brand 1999 ; Aitio 2005 ). Se cree que la N-acetilcisteína inhalada aumenta el aclaramiento del esputo en las vías respiratorias al reducir los enlaces disulfuro y la viscosidad del moco, pero no aumenta los niveles sistémicos de GSH ( Atkuri et al., 2007) La administración oral de N-acetilcisteína, por otro lado, aumenta los niveles de GSH al proporcionar al hígado un mayor suministro de cisteína que promueve un aumento en la síntesis de GSH. Se ha demostrado que el tratamiento oral con N-acetilcisteína aumenta las concentraciones de GSH en neutrófilos y en sangre total, disminuye el reclutamiento de neutrófilos en las vías respiratorias y disminuye la actividad de elastasa, una medida de la disfunción pulmonar de fibrosis quística, aunque otras medidas de la función pulmonar no mejoraron ( Tirouvanziam et al. ., 2006 ). El análisis de cinco estudios adicionales sobre la función pulmonar después del tratamiento con N-acetilcisteína muestra pequeñas mejoras en la función pulmonar ( Duijvestijn y Brand 1999); sin embargo, cada uno de estos estudios son estudios a corto plazo, y falta una evaluación a largo plazo de los beneficios de la N-acetilcisteína para la función pulmonar.
La intervención terapéutica con S- nitrosoglutatión también puede beneficiar a los pacientes con fibrosis quística. El S- Nitrosoglutatión es una molécula endógena que relaja el músculo liso de las vías respiratorias, mejora la motilidad de los cilios de las vías respiratorias y tiene efectos antimicrobianos ( Hudson, 2001 ). Los niveles de S- nitrosoglutatión pulmonar disminuyen en pacientes con fibrosis quística ( Grasemann et al., 1999 ). Se ha demostrado que la inhalación de S- nitrosoglutatión es bien tolerada por un pequeño grupo de pacientes con fibrosis quística y provocó un aumento modesto de la oxigenación ( Snyder et al., 2002 ). Agregar niveles fisiológicos de S-nitrosoglutatión a las líneas celulares que expresan ΔF508-CFTR y células epiteliales nasales primarias de pacientes con fibrosis quística mejora la maduración de CFTR, la expresión en la membrana plasmática y el flujo de cloruro ( Zaman et al., 2001 ; Andersson et al., 2002 ; Howard et al. ., 2003 ; Chen et al., 2006 ; Servetnyk et al., 2006 ). Sin embargo, es posible que sea necesario utilizar S- nitrosoglutatión junto con un tratamiento adicional que ayude a la estabilidad de la proteína, porque el ΔF508-CFTR parece ser inestable en la membrana plasmática después del tratamiento con S- nitrosoglutatión ( Howard et al., 2003 ).
Enfermedades inflamatorias y del sistema inmunitario.
Se está prestando una atención creciente al papel que juega el estado del tiol durante el inicio y la progresión de los estados inflamatorios y autoinmunes, así como la efectividad de las terapias de repleción de tiol en el tratamiento de enfermedades inmunes. Los niveles celulares de GSH afectan la maduración de las células T auxiliares ( Peterson et al., 1998 ), la proliferación de células T ( Messina y Lawrence, 1989 ), la replicación viral ( Staal et al., 1990 ; Palamara et al., 1995 ; Cai et al., 2003), así como la susceptibilidad a las especies reactivas secretadas por las células inflamatorias. Mantener una función adecuada de las células T es fundamental para provocar una respuesta inmune adecuada, ya que las anomalías a menudo provocan la enfermedad. Además, existen muchas correlaciones entre la disfunción del sistema inmunitario y las alteraciones en los niveles de GSH, como se resume a continuación. En la mayoría de los casos, el mecanismo para el cambio en los niveles de GSH no ha sido identificado.
GSH y equilibrio Th1 / Th2
Las células T helper juegan un papel importante en la dirección de respuestas inmunes apropiadas. Las células T helper 1 (Th1) controlan la inmunidad celular y combaten virus, patógenos intracelulares y células cancerosas; mientras que las células T helper 2 (Th2) provocan inmunidad humoral y aumentan la producción de anticuerpos para combatir organismos multicelulares. El desequilibrio Th1 / Th2 es un sello distintivo en muchas enfermedades inmunes ( Romagnani, 1996 ). La respuesta Th1 es hiperactiva en una serie de enfermedades autoinmunes específicas de órganos, incluida la artritis reumatoide, la diabetes tipo 1 y la esclerosis múltiple, mientras que la actividad de la vía Th2 está asociada con alergias y enfermedades basadas en IgE y autoinmunidad sistémica ( Kidd, 2003 ) . Varios factores influyen en la maduración Th1 / Th2, incluidos los niveles de GSH. Peterson y col. (1998)informó que el agotamiento de GSH en las células presentadoras de antígeno inhibe la producción de citocinas relacionadas con Th1 (interferón gamma e interleucina 12), y apoya la respuesta inmune humoral mediada por Th2. Además, cuando las células presentadoras de antígeno tienen niveles elevados de GSH intracelular, secretan citocinas que favorecen el desarrollo de células Th1 ( Murata et al., 2002 ). Además, Murata et al. (2002)descubrió que las citocinas específicas pueden alterar los niveles de GSH en las células presentadoras de antígeno. La exposición a IFN-gamma, una citocina Th1, dio lugar a un aumento de los niveles de GSH, mientras que la exposición a IL-4, una citocina Th2, dio lugar a una disminución de GSH intracelular. Debido a que GSH tiene un impacto significativo en la capacidad del sistema inmune para activar la respuesta Th apropiada, la alteración de sus niveles puede tener implicaciones significativas en las enfermedades relacionadas con Th1 / Th2.
Curiosamente, los niveles bajos de GSH están asociados con muchas enfermedades autoinmunes e inflamatorias, incluida la artritis reumatoide ( Hassan et al., 2001 ), el lupus eritematoso sistémico ( Perl et al., 2004 ), la enfermedad de Crohn ( Sido et al., 1998 ), esclerosis múltiple ( Zargari et al., 2007 ), psoriasis ( Kokcam y Naziroglu, 1999 ) y dermatitis de contacto ( Eisen et al., 2004) Sin embargo, debido a que esta lista de enfermedades no cae exclusivamente en la categoría de trastorno Th1-dominante o Th2-dominante, sugiere que los niveles comprometidos de GSH pueden ser un factor más crítico en el inicio inicial de estas afecciones. Esta hipótesis está respaldada por la observación de que en el lupus eritematoso sistémico, el dominio de Th-2 ocurre en etapas tempranas de la enfermedad ( Horwitz et al., 1998 ), y que el compromiso Th-1 prevalece en la progresión posterior de la enfermedad ( Akahoshi et al., 1999 )
En general, las altas cargas de oxidantes son una característica común en muchas disfunciones inmunes y GSH juega un papel importante en la extinción de estas especies oxidantes y, por lo tanto, protege a la célula del daño. Por lo tanto, cualquier disminución de GSH puede influir en el sistema inmunitario al perpetuar los eventos de señalización de especies reactivas y aumentar el daño relacionado con ROS. Curiosamente, se sabe que varios estímulos en las concentraciones que agotan los niveles de GSH, como el etanol, la irradiación, la ciclofosfamida y el estrés, alteran la respuesta inmune ( Peterson et al., 1998 ). Recientemente, ha habido un creciente interés en los informes que asocian el uso de acetaminofén (un conocido agente de reducción de GSH), con un mayor riesgo de asma ( Shaheen et al., 2000 ; Barr et al., 2004 ;Eneli et al., 2005 ; McKeever et al., 2005 ).
GSH e infección viral
Además de afectar el equilibrio Th1 / Th2, los tioles intracelulares se han implicado en la proliferación de células T que ocurre durante la infección viral ( Hamilos et al., 1989 ; Messina y Lawrence, 1989 ; Hadzic et al., 2005 ). En particular, se observan niveles bajos de GSH intracelular en individuos infectados con VIH, y se asocian con una disminución de la supervivencia de los pacientes afectados ( Herzenberg et al., 1997 ). Los niveles de GSH son más bajos en el plasma sanguíneo, el líquido del revestimiento epitelial, las células mononucleares de sangre periférica y los monocitos de individuos infectados por el VIH ( Buhl et al., 1989) Ni el mecanismo para el agotamiento de GSH, ni la importancia funcional de los niveles más bajos de GSH aún se conocen. Curiosamente, los niveles más bajos de GSH tienden a favorecer la replicación viral del VIH y, por lo tanto, pueden facilitar la progresión de la enfermedad. No está claro cómo ocurre esto, aunque existe evidencia de que la deficiencia de GSH mejora las vías de transducción de señales asociadas con la expresión del VIH ( Duh et al., 1989 ). Se sabe que los niveles disminuidos de GSH activan NFκB, que se ha demostrado que se une y activa genes controlados por la repetición terminal larga del VIH ( Duh et al., 1989 ), y por lo tanto puede afectar la replicación viral. Se ha demostrado que la suplementación con N-acetilcisteína bloquea la expresión del gen de repetición terminal larga del VIH ( Staal et al., 1990) Además, el agotamiento de linfocitos CD4 + acompaña la progresión del VIH y la disminución de los niveles de GSH contribuye a la apoptosis en estas células CD4 + ( Suthanthiran et al., 1990 ).
Los experimentos in vitro e in vivo muestran que los niveles mejorados de GSH también inhiben la replicación tanto del virus de la influenza ( Nencioni et al., 2003 ) como del virus del herpes simple ( Vogel et al., 2005 ). Los niveles de GSH no solo parecen afectar la actividad de los virus invasores, sino que también afectan la activación de importantes vías de señalización celular asociadas con la respuesta del sistema inmunitario del huésped. Hay muchas formas en que GSH afecta la señalización celular, incluyendo la modulación de los radicales libres intracelulares, el mantenimiento del estado de las proteínas en el tiol y la unión covalente de los restos de cisteína en las proteínas citosólicas ( glutationilación S ;Tabla 2) Un ejemplo que es especialmente importante para la regulación de la función inmune es la sensibilidad de la actividad tirosina fosfatasa al estado de tiol intracelular ( Zipser et al., 1997 ; Mustelin et al., 2005 ). Los niveles de GSH Baja acentúan H 2 O 2 inducida por tirosina fosforilación ( Iantomasi et al., 2001 ).
No es sorprendente que haya habido conexiones interesantes entre los niveles de GSH y las vías de señalización celular involucradas en las respuestas inmunes. Bruchhausen y col. (2003) informaron que los tioles, como la N-acetilcisteína, son específicamente capaces de inhibir las reacciones de sensibilización por contacto en las células presentadoras de antígeno mediante la inhibición de la fosforilación de la tirosina, mientras que otros antioxidantes, como el ácido absorbente y el alfa-tocoferol fueron ineficaces. Además, la incubación con tioles fue capaz de mejorar los defectos en la actividad de tirosina fosfatasa y las respuestas proliferativas en linfocitos CD4 + infectados por VIH ( Cayota et al., 1996 ).
Diabetes mellitus
La síntesis de GSH y el metabolismo también se alteran durante la hiperglucemia y la diabetes. La diabetes mellitus se caracteriza por hiperglucemia, la elevación crónica prolongada de glucosa y deficiencia de insulina. La diabetes tipo 1 se caracteriza por una destrucción autoinmune de las células β productoras de insulina en el páncreas. Se cree que los aumentos en las especies reactivas de oxígeno de los macrófagos y la inflamación contribuyen a la destrucción inicial de las células β ( Kaneto et al., 2007) La diabetes tipo 2 ocurre a través de una variedad de orígenes poligénicos y ambientales, como la obesidad, que son el resultado de una combinación de insensibilidad a la insulina en los tejidos periféricos y / o una deficiencia pancreática productora de insulina de células β. Las complicaciones de la diabetes incluyen: patología de la retina, glomérulo renal, daño a los nervios periféricos y aceleración de la enfermedad aterosclerótica que afecta las arterias del corazón, el cerebro y las extremidades inferiores, todo lo cual puede conducir a amputaciones, ceguera, insuficiencia renal y muerte.
Curiosamente, las concentraciones de GSH son más bajas en los eritrocitos y plasma sanguíneo de pacientes diabéticos y pacientes con síndrome metabólico, que tienen un alto riesgo de desarrollar diabetes ( Yoshida et al., 1995 ; Sharma et al., 2000 ; Giral et al., 2008) Los niveles más bajos de GSH en diabéticos potencian los efectos del aumento de las especies reactivas de oxígeno. Los niveles de GSH parecen estar disminuidos por al menos dos mecanismos diferentes: los efectos directos de la glucosa y la insulina en la síntesis de GSH, y por el consumo de un cofactor requerido para la regeneración de GSH a partir de GSSG (es decir, NAPDH) a través de la vía del poliol. La primera enzima de la ruta del poliol es la aldosa reductasa, que convierte la glucosa en sorbitol a través de una reacción dependiente de NADPH. Curiosamente, la actividad de la aldosa reductasa parece estar regulada por la glutatión S (Tabla 2; Cappiello et al., 2001 ), que proporciona un vínculo adicional entre GSH y estos estados de enfermedad. Los cambios en las actividades enzimáticas dependientes de GSH, como la glutatión peroxidasa, la γ-glutamil transpeptidasa y la glutatión S -transferasa también se observan en la diabetes.
Efectos de la insulina y la glucosa en la síntesis de GSH
La hiperglucemia y la insulina parecen regular los niveles de GSH a través de la γ-glutamilcisteína ligasa, la enzima limitante de la velocidad de síntesis de GSH. La exposición prolongada a condiciones de glucosa alta conduce a una disminución en los niveles de GSH celular y disminuye en el ARNm tanto para las subunidades catalíticas como reguladoras de la γ-glutamilcisteína ligasa ( Urata et al., 1996 ; Lu et al., 1999 ; Catherwood et al., 2002 ). También se han observado disminuciones en la actividad de la γ-glutamilcisteína ligasa en los eritrocitos de pacientes diabéticos ( Yoshida et al., 1995 ). La actividad de la glutatión sintetasa, la otra enzima involucrada en la síntesis de GSH, no parece verse afectada en la diabetes ( Lu et al., 1992) En contraste con el efecto de la glucosa en los niveles de GSH, los niveles altos y fisiológicos de insulina aumentan el contenido de GSH, el ARNm y la proteína de la subunidad catalítica de la γ-glutamilcisteína ligasa y los niveles de actividad de la γ-glutamilcisteína ligasa en los hepatocitos primarios de rata ( Lu et al., 1992 ; Cai et al., 1995 ; Kim et al., 2004 ). La insulina también aumenta el contenido de GSH en eritrocitos cultivados de pacientes diabéticos ( Bravi et al., 2006 ). Los niveles de proteína y ARNm de la subunidad catalítica de la γ-glutamilcisteína ligasa parecen aumentar en mayor medida que el contenido de GSH en respuesta al tratamiento con insulina ( Kim et al., 2004) La insulina no afecta la subunidad reguladora de la γ-glutamilcisteína ligasa y esto puede ser un factor limitante en el aumento de los niveles de GSH ( Cai et al., 1997 ; Kim et al., 2004 ). Por lo tanto, como se sabe que los niveles altos de glucosa / insulina bajos aumentan las especies reactivas de oxígeno, la disminución concomitante en la síntesis de GSH y los niveles de GSH debilitarán las defensas celulares contra el estrés oxidativo.
La ruta del poliol
La vía del poliol puede conducir a una reducción en GSH debido al consumo de NADPH en la conversión de glucosa en sorbitol por la enzima aldosa reductasa ( Brownlee, 2001 ). En condiciones normales de glucosa, esta vía reduce poca glucosa; sin embargo, durante condiciones hiperglucémicas, la reducción de glucosa por la vía del poliol aumenta junto con una disminución en los niveles de NADPH. El consumo de NADPH en esta vía puede comprometer la regeneración de GSH reducido, porque la glutatión reductasa usa NADPH para convertir GSSG nuevamente en GSH. Bajo condiciones de estrés oxidativo, esto puede conducir al agotamiento de GSH.
Baja actividad de la glutatión peroxidasa en las células β pancreáticas
Las células β pancreáticas tienen un alto riesgo de daño oxidativo debido a niveles comparativamente más bajos de enzimas antioxidantes que otros tejidos, incluyendo glutatión peroxidasa, superóxido dismutasa y catalasa ( Tiedge et al., 1997 ). La exposición a altas concentraciones de glucosa no aumenta la expresión de glutatión peroxidasa en las células de los islotes, como se observa en otros tejidos ( Tiedge et al., 1997) Los bajos niveles iniciales de glutatión peroxidasa y la incapacidad de las células de los islotes para aumentar la expresión de glutatión peroxidasa debido al estrés oxidativo, hace que estas células productoras de insulina sean vulnerables. Además, los bajos niveles de GSH en la diabetes disminuyen el sustrato disponible para la actividad glutatión peroxidasa, lo que contribuye a la baja actividad observada en la periferia y deja a estas células menos capaces de desintoxicar los peróxidos de hidrógeno. Por ejemplo, la exposición prolongada a glucosa elevada disminuye la actividad glutatión peroxidasa en las células endoteliales vasculares, las células renales y las mitocondrias cerebrales ( Urata et al., 1996 ; Catherwood et al., 2002 ; Mastrocola et al., 2005) Además, GSH forma aductos con monosacáridos, que pueden estar elevados en las células durante la diabetes, y estos aductos no pueden usarse como sustratos adecuados para la glutatión peroxidasa, lo que también puede contribuir a la disminución de la actividad enzimática ( Januel et al., 2003 ).
γ-Glutamil transpeptidasa y glutatión S-transferasas
Otras enzimas relacionadas con el glutatión, como la γ-glutamil transpeptidasa y la glutatión S- transferasa parecen verse afectadas por cambios en los niveles de glucosa y / o insulina, aunque estas enzimas también se ven alteradas por especies reactivas de oxígeno. La actividad hepática de γ-glutamil transpeptidasa aumenta en un modelo de rata diabética y el tratamiento con insulina restablece la actividad de γ-glutamil transpeptidasa a la normalidad ( McLennan et al., 1991 ; Lu et al., 1997 ). Los niveles de GSH en la bilis son más bajos en estos modelos y la inhibición de la transpeptidasa de γ-glutamil con acivicina restaura parcialmente los niveles de GSH ( Lu et al., 1997 ). El aumento de la descomposición de GSH en la bilis puede contribuir al flujo de bilis alterado que se observa en los modelos de diabetes. Además, glutatión SLas transferasas parecen estar alteradas diferencialmente por los niveles de insulina o glucosa. La glutatión S -transferasa de clase alfa aumenta con la insulina y el glucagón disminuye la glutatión S -transferasa alfa y piclass . mientras que la glutatión S -transferasa de clase mu no es sensible a estos compuestos ( Kim et al., 2003 ). La transcripción de las enzimas glutatión S -transferasa también puede verse afectada por el estado redox y el estrés oxidativo a través del elemento de respuesta antioxidante presente en la región promotora ( Wasserman y Fahl, 1997 ). Aunque las ramificaciones exactas de estos cambios en γ-glutamil transpeptidasa y glutatión S-transferasa al estado diabético no son claras, confirman aún más la importancia del metabolismo de GSH y las enzimas dependientes de GSH en la diabetes.
Terapias basadas en GSH en diabetes
La infusión de GSH en pacientes con diabetes no dependientes de insulina mejora la captación de glucosa mediada por insulina y los niveles de GSH en eritrocitos, aunque los efectos son modestos y requieren una infusión de una hora ( De Mattia et al., 1998 ). La N-acetilcisteína también se ha utilizado para mejorar el estado redox de las células. El tratamiento de las células de los islotes pancreáticos con N-acetilcisteína previene la disminución del contenido de ARNm y proteínas de la insulina después de la exposición a la ribosa, y el tratamiento conjunto con N-acetilcisteína y un inhibidor de la síntesis de GSH anula este efecto, lo que sugiere que el aumento de la síntesis de GSH protege a los islotes de la toxicidad. ( Tanaka et al., 2002) El tratamiento de modelos de ratas o ratones que desarrollan características de diabetes tipo 2 a medida que envejecen con N-acetilcisteína previene parcialmente el desarrollo de hiperglucemia y la disminución del ARNm de insulina que de otro modo ocurriría ( Kaneto et al., 1999 ; Tanaka et al., 1999 ) La N-acetilcisteína también reduce la apoptosis en las células β pancreáticas de un modelo de ratón diabético, ya que la masa de células β fue mayor en los ratones diabéticos tratados con N-acetilcisteína que en los ratones diabéticos no tratados ( Kaneto et al., 1999 ). Además, la administración de N-acetilcisteína a ratas diabéticas inducidas por estreptozotocina previene la apoptosis y otros daños a los glomérulos ( Odetti et al., 2003) Estos resultados sugieren que la N-acetilcisteína puede atenuar la transición de la hiperglucemia crónica al desarrollo de diabetes y podría prevenir el daño en los tejidos periféricos.
Las terapias basadas en GSH también pueden ser beneficiosas en embarazos diabéticos. Los embriones de rata incubados en medios con alto contenido de glucosa o de ratas preñadas diabéticas tienen menos actividad de GSH, γ-glutamilcisteína ligasa y expresión de ARNm de γ-glutamilcisteína ligasa ( Trocino et al., 1995 ; Sakamaki et al., 1999 ). Después de la suplementación con éster GSH, se observa la recuperación parcial de los niveles de GSH y la actividad de la γ-glutamilcisteína ligasa durante las condiciones hiperglucémicas, mejorando el crecimiento y disminuyendo las malformaciones en embriones incubados en condiciones de glucosa elevada ( Trocino et al., 1995 ). El tratamiento con éster o insulina GSH de madres diabéticas mejoró las concentraciones de GSH, las lesiones neurales y el crecimiento en los embriones de rata ( Sakamaki et al., 1999) Por lo tanto, mejorar el estado de GSH en madres diabéticas puede ser beneficioso para el crecimiento y desarrollo del bebé.
Resumen
Los cambios en los niveles de GSH y / o el estado de oxidación ahora se han reportado en casi todas las principales enfermedades humanas. Aunque en muchos casos estos cambios probablemente ocurran como resultado de la progresión de la enfermedad subyacente, en otros casos estos cambios están estrechamente relacionados con el inicio y / o desarrollo de la enfermedad. El creciente reconocimiento de que GSH está involucrado en vías críticas de señalización celular que están reguladas por S-glutationilación y / o por el estado tiol redox, y que GSH puede funcionar como un neurotransmisor o neuromodulador, proporciona una nueva visión considerable sobre los posibles vínculos entre GSH y la progresión de la enfermedad, y plantea preguntas adicionales que pueden abordarse experimentalmente. Además, el reconocimiento de que GSH está íntimamente involucrado en tantos estados de enfermedad ha generado un interés considerable en identificar terapias dirigidas a modular los niveles de GSH para modular el riesgo o la progresión de la enfermedad. Aunque tales terapias tienen obstáculos importantes que superar, ofrecen una promesa significativa para muchas enfermedades humanas.
Agradecimientos
Nuestras disculpas por los muchos informes relevantes que no pudimos citar debido a limitaciones de espacio o supervisión. Este trabajo fue apoyado en parte por la beca DK48823 del Instituto Nacional de Salud, las subvenciones del Centro NIEHS ES01247 y ES03828, y las subvenciones del programa de capacitación en toxicología ES07026 y ES16254.
Referencias
-
Adams JD, Jr, Klaidman LK, Odunze IN, Shen HC, Miller CA. Enfermedad de Alzheimer y Parkinson. Niveles cerebrales de glutatión, disulfuro de glutatión y vitamina E. Mol. Chem Neuropatol 1991; 14 : 213–226. [ PubMed ] [ Google Scholar ]
-
Aitio M. N-acetilcisteína "passé-partout o mucho ruido y pocas nueces? Br. J. Clin. Pharmacol. 2005; 61 : 5–15. [ Artículo libre de PMC ] [ PubMed ] [ Google Scholar ]
-
Akahoshi M, Nakashima H, Tanaka Y, Kohsaka T, Nagano S, Ohgami E, Arinobu Y, Yamaoka K, Niiro H, Shinozaki M, Hirakata H, Horiuchi T, Otsuka T, Niho Y. Th1 / Th2 equilibrio del periférico T helper células en lupus eritematoso sistémico. Artritis. Reuma. 1999; 42 : 1644-1648. [ PubMed ] [ Google Scholar ]
-
Andersson C, Gaston B, GM de Roomans. S-nitrosoglutatión induce DeltaF508-CFTR funcional en las células epiteliales de las vías respiratorias. Biochem Biophys Res Commun. 2002; 297 : 552–557. [ PubMed ] [ Google Scholar ]
-
Atkuri KR, Mantovani JJ, Herzenberg LA, Herzenberg LA. N-acetilcisteína: un antídoto seguro para la deficiencia de cisteína / glutatión. Curr. Opin. Pharmacol 2007; 7 : 355–359. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Balendiran GK, Dabur R, Fraser D. El papel del glutatión en el cáncer. Célula. Biochem. Funct. 2004; 22 : 343–352. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Truong AT. Relación entre la excreción biliar de glutatión y el flujo biliar independiente del ácido biliar. A.m. J. Physiol. 1989; 256 : G22 – G30. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Truong AT. El glutatión como fuerza impulsora osmótica primaria en la formación de bilis hepática. A.m. J. Physiol. 1992; 263 : G617 – G624. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Gatmaitan Z, Truong AT. Alteración de la excreción biliar y eliminación de todo el cuerpo de metilmercurio en ratas con defecto congénito en la excreción biliar de glutatión. Hepatología 1995; 22 : 1469–1473. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Moseley RH, Boyer JL. El transporte de L-glutamato dependiente del gradiente de sodio se localiza en el dominio canalicular de las membranas plasmáticas del hígado. Estudios en vesículas de membrana sinusoidal y canalicular de hígado de rata. J. Biol. Chem 1986a; 261 : 6216–6221. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Jacob R, Boyer JL. Hidrólisis de glutatión intrabiliar: una fuente de glutamato en la bilis. J. Biol. Chem 1986b; 261 : 7860–7865. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Jacob R, Barrett C, Boyer JL. Catabolismo biliar de glutatión y reabsorción diferencial de sus componentes de aminoácidos. A.m. J. Physiol. 1988; 254 : G1 – G7. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Truong AT, Ma AK, Boyer JL. Determinantes del flujo de glutatión y la relación biliar GSH / GSSG en hígado de rata perfundido. A.m. J. Physiol. 1989; 256 : G482 – G490. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Hammond CL, Cunningham JB, Krance SM, Marchan R. Mecanismos moleculares de transporte reducido de glutatión: papel de las familias de proteínas de membrana MRP / CFTR / ABCC y OATP / SLC21A. Toxicol Appl. Pharmacol 2005; 204 : 238–255. [ PubMed ] [ Google Scholar ]
-
Ballatori N, Krance SM, Marchan R, Hammond CL. Transportadores de glutatión en la membrana plasmática y sus funciones en la fisiología y la fisiopatología celular. Mol. Aspectos Medicina. 2008 [Epub antes de la impresión] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Barr RG, Wentowski CC, Curhan GC, Somers SC, Stampfer MJ, Schwartz J, Speizer FE, Camargo CA., Jr Estudio prospectivo del uso de acetaminofén y asma recién diagnosticada en mujeres. A.m. J. Respir. Crit. Care Med. 2004; 169 : 836–841. [ PubMed ] [ Google Scholar ]
-
Beal MF. Proteínas oxidativamente modificadas en el envejecimiento y la enfermedad. Radic Libre. Biol. Medicina. 2002; 32 : 797–803. [ PubMed ] [ Google Scholar ]
-
Benlloch M, Ortega A, Ferrer P, Segarra R, Obrador E, Asensi M, Carretero J, Estrela JM. La aceleración del flujo de salida de glutatión y la inhibición de la gamma-glutamiltranspeptidasa sensibilizan las células metastásicas de melanoma B16 a la citotoxicidad inducida por el endotelio. J. Biol. Chem 2005; 280 : 6950-6959. [ PubMed ] [ Google Scholar ]
-
Bentley AR, Emrani P, Cassano PA. Variación genética y expresión génica en enzimas relacionadas con antioxidantes y riesgo de enfermedad pulmonar obstructiva crónica: una revisión sistemática. Tórax. 2008 [Epub antes de la impresión] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Berndt C, Lillig CH, Holmgren A. Mecanismos basados en tiol de los sistemas de tiorredoxina y glutaredoxina: implicaciones para las enfermedades en el sistema cardiovascular. A.m. J. Physiol. Circ. Corazón Physiol 2007; 292 : H1227 – H1236. [ PubMed ] [ Google Scholar ]
-
Bhat KS, John A, Reddy PR, Reddy PS, Reddy VN. Efecto de la pigmentación sobre la defensa antioxidante del ciclo redox de glutatión en regiones enteras y diferentes de lentes cataractas humanos. Exp. Eye Res. 1991; 52 : 715–721. [ PubMed ] [ Google Scholar ]
-
Obispo C, Hudson VM, Hilton SC, Wilde C. Un estudio piloto del efecto del glutatión reducido tamponado inhalado en el estado clínico de pacientes con fibrosis quística. Cofre. 2005; 127 : 308–317. [ PubMed ] [ Google Scholar ]
-
Bojes HK, Datta K, Xu J, Chin A, Simonian P, Nunez G, Kehrer JP. La sobreexpresión de Bcl-xL atenúa el agotamiento de glutatión en las células FL5.12 después de la retirada de interleucina-3. Biochem. J. 1997; 325 : 315–319. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Bolaños JP, Heales SJ, Land JM, Clark JB. Efecto del peroxinitrito sobre la cadena respiratoria mitocondrial: susceptibilidad diferencial de neuronas y astrocitos en cultivo primario. J. Neurochem. 1995; 64 : 1965-1972. [ PubMed ] [ Google Scholar ]
-
Borst P, Elferink RO. Transportadores ABC de mamíferos en salud y enfermedad. Annu Rev. Biochem. 2002; 71 : 537–592. [ PubMed ] [ Google Scholar ]
-
Bravi MC, Armiento A, Laurenti O, Cassone-Faldetta M, De Luca O, Moretti A, De Mattia G. La insulina disminuye el estrés oxidativo intracelular en pacientes con diabetes mellitus tipo 2. Metabolismo. 2006; 55 : 691–695. [ PubMed ] [ Google Scholar ]
-
Brownlee M. Bioquímica y biología celular molecular de las complicaciones diabéticas. Naturaleza. 2001; 414 : 813–820. [ PubMed ] [ Google Scholar ]
-
Bruchhausen S, Zahn S, Valk E, Knop J, Becker D. Los antioxidantes tiol bloquean la activación de las células presentadoras de antígeno por sensibilizadores de contacto. J. Invest. Dermatol 2003; 121 : 1039-1044. [ PubMed ] [ Google Scholar ]
-
Buhl R, Jaffe HA, Holroyd KJ, Wells FB, Mastrangeli A, Saltini C, Cantin AM, Crystal RG. Deficiencia sistémica de glutatión en individuos seropositivos al VIH sin síntomas. Lanceta. 1989; 2 : 1294-1298. [ PubMed ] [ Google Scholar ]
-
Buhl R, Vogelmeier C, Critenden M, Hubbard RC, Hoyt RF, Jr, Wilson EM, Cantin AM, Crystal RG. Aumento de glutatión en el líquido que recubre el epitelio del tracto respiratorio inferior mediante la administración directa de aerosol de glutatión. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1990; 87 : 4063–4067. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Burwell LS, Nadtochiy SM, Tompkins AJ, Young S, Brookes PS. Evidencia directa para la nitrosación S del complejo mitocondrial I. Biochem. J. 2006; 394 : 627-634. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Cai J, Sun WM, Lu SC. Regulación hormonal y de la densidad celular de la expresión del gen hepático gamma-glutamilcisteína sintetasa. Mol. Pharmacol 1995; 48 : 212–218. [ PubMed ] [ Google Scholar ]
-
Cai J, Huang ZZ, Lu SC. Regulación diferencial de la expresión génica de la subunidad pesada y ligera de la gamma-glutamilcisteína sintetasa. Biochem. J. 1997; 326 : 167-172. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Cai J, Chen Y, Seth S, Furukawa S, Compans RW, Jones DP. Inhibición de la infección por influenza por glutatión. Radic Libre. Biol. Medicina. 2003; 34 : 928–936. [ PubMed ] [ Google Scholar ]
-
Calvert P, Yao KS, Hamilton TC, O'Dwyer PJ. Estudios clínicos de reversión de resistencia a medicamentos basados en glutatión. Chem Biol. Interactuar. 1998; 111–112 : 213–224. [ PubMed ] [ Google Scholar ]
-
Calvin HI, Medvedovsky C, Worgul BV. Depleción de glutatión casi total y cataratas específicas por edad inducidas por butionina sulfoximina en ratones. Ciencias. 1986; 233 : 553–555. [ PubMed ] [ Google Scholar ]
-
Cantin AM, North SL, Hubbard RC, Crystal RG. El líquido de revestimiento epitelial alveolar normal contiene altos niveles de glutatión. J. Appl. Physiol 1987; 63 : 152-157. [ PubMed ] [ Google Scholar ]
-
Cantin AM, White TB, Cross CE, Forman HJ, Sokol RJ, Borowitz D. Antioxidantes en la fibrosis quística. Conclusiones del taller de antioxidantes de la FQ, Bethesda, Maryland, del 11 al 12 de noviembre de 2003. Radical libre. Biol. Medicina. 2007; 42 : 15–31. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Cappiello M y col. Modulación de la actividad de la aldosa reductasa a través de S-tiolación por tioles fisiológicos. Chem Biol. Interactuar. 2001; 130–132 : 597–608. [ PubMed ] [ Google Scholar ]
-
Catherwood MA, Powell LA, Anderson P, McMaster D, Sharpe PC, Trimble ER. Estrés oxidativo inducido por glucosa en células mesangiales. Riñón Int. 2002; 61 : 599-608. [ PubMed ] [ Google Scholar ]
-
Cayota A, Vuillier F, Gonzalez G, Dighiero G. Los linfocitos CD4 + de pacientes infectados por VIH muestran una actividad de tirosina fosfatasa asociada a CD45 deteriorada que se ve reforzada por los antioxidantes. Clin. Exp. Immunol 1996; 104 : 11-17. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Celli A, Que FG, Gores GJ, LaRusso NF. El agotamiento del glutatión se asocia con una disminución de la expresión de Bcl-2 y un aumento de la apoptosis en los colangiocitos. A.m. J. Physiol. 1998; 275 : G749 – G757. [ PubMed ] [ Google Scholar ]
-
Cerutti PA. Estados prooxidantes y promoción tumoral. Ciencias. 1985; 227 : 375–381. [ PubMed ] [ Google Scholar ]
-
Chen L, Patel RP, Teng X, Bosworth CA, Lancaster JR, Jr, Matalon S. Mecanismos de activación del regulador de conductancia transmembrana de fibrosis quística por S- nitrosoglutatión. J Biol. Chem 2006; 281 : 9190–9199. [ PubMed ] [ Google Scholar ]
-
Chinta SJ, Kumar MJ, Hsu M, Rajagopalan S, Kaur D, Rane A, Nicholls DG, Choi J, Andersen JK. Las alteraciones inducibles de los niveles de glutatión en las neuronas dopaminérgicas del mesencéfalo adulto provocan degeneración nigrostriatal. J. Neurosci. 2007; 27 : 13997–14006. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Chu XY, Strauss JR, Mariano MA, Li J, Newton DJ, Cai X, Wang RW, Yabut J, Hartley DP, Evans DC, Evers R. Caracterización de ratones que carecen de la proteína de resistencia a múltiples fármacos MRP2 (ABCC2) J. Pharmacol. Exp. El r. 2006; 317 : 579–589. [ PubMed ] [ Google Scholar ]
-
Cobb MH, Heagy W, Danner J, Lenhoff HM, Marshall GR. Propiedades estructurales y conformacionales de los péptidos que interactúan con el receptor de glutatión de la hidra. Mol Pharmacol. mil novecientos ochenta y dos; 21 : 629-636. [ PubMed ] [ Google Scholar ]
-
Cohen SM, Olin KL, Feuer WJ, Hjelmeland L, Keen CL, Morse LS. Baja actividad de glutatión reductasa y peroxidasa en la degeneración macular relacionada con la edad. Br. J. Ophthalmol. 1994; 78 : 791–794. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Conseil GC, Deeley RG, Cole SPC. Polimorfismos de MRP1 (ABCC1) y transportadores de drogas dependientes de ATP relacionados. Pharmacogenet Genómica 2005; 15 : 523-533. [ PubMed ] [ Google Scholar ]
-
Coppola S, extrusión de Ghibelli L. GSH y la vía mitocondrial de señalización apoptótica. Biochem. Soc. Trans. 2000; 28 : 56–61. [ PubMed ] [ Google Scholar ]
-
Coral K, Raman R, Rathi S, Rajesh M, Sulochana KN, Angayarkanni N, Paul PG, Ramakrishnan S. Homocisteína plasmática y contenido total de tiol en pacientes con degeneración macular exudativa relacionada con la edad. Ojo. 2006; 20 : 203-207. [ PubMed ] [ Google Scholar ]
-
Csala M, Fulceri R, Mandl J, Benedetti A, Bánhegyi G. Transporte de glutatión en el retículo endo / sarcoplásmico. Biofactores. 2003; 17 : 27–35. [ PubMed ] [ Google Scholar ]
-
Dalle-Donne I, Rossi R, Giustarini D, Colombo R, Milzani A. S -Glutationilación en la regulación de la proteína redox. Radic libre Biol Med. 2007; 43 : 883–898. [ PubMed ] [ Google Scholar ]
-
Dalton TP, Dieter MZ, Yang Y, Shertzer HG, Nebert DW. Knockout del gen de la subunidad catalítica de glutamato cisteína ligasa de ratón (Gclc): letal embrionario cuando es homocigoto, y modelo propuesto para la deficiencia moderada de glutatión cuando es heterocigoto. Biochem. Biophys Res. Commun. 2000; 279 : 324–329. [ PubMed ] [ Google Scholar ]
-
Dalton TP, Chen Y, Schneider SN, Nebert DW, Shertzer HG. Ratones genéticamente alterados para evaluar la homeostasis del glutatión en la salud y la enfermedad. Radic Libre. Biol. Medicina. 2004; 37 : 1511-1526. [ PubMed ] [ Google Scholar ]
-
Dauer W, enfermedad de Przedborski S. Parkinson: mecanismos y modelos. Neurona. 2003; 39 : 889-909. [ PubMed ] [ Google Scholar ]
-
David LL, Shearer TR. Estado del sulfhidrilo en la catarata de selenita. Toxicol Appl. Pharmacol 1984; 74 : 109-115. [ PubMed ] [ Google Scholar ]
-
Davies JC, Alton EW, Bush A. Fibrosis quística. BMJ. 2007; 335 : 1255-1259. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Día BJ, van Heeckeren AM, Min E, Velsor LW. Papel para la proteína reguladora de la conductancia transmembrana de la fibrosis quística en una respuesta de glutatión a la infección broncopulmonar por pseudomonas. Infectar. Immun 2004; 72 : 2045-2051. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Deeley RG, Westlake C, Cole SPC. Transporte transmembrana de endo y xenobióticos por proteínas de resistencia a múltiples fármacos casetes de unión a ATP de mamífero. Physiol Rev. 2006; 86 : 849–899. [ PubMed ] [ Google Scholar ]
-
DeLeve LD, Kaplowitz N. Importancia y regulación del glutatión hepático. Semin. Hígado Dis. 1990; 10 : 251–266. [ PubMed ] [ Google Scholar ]
-
De Mattia G, Bravi MC, Laurenti O, Cassone-Faldetta M, Armiento A, Ferri C, Balsano F. Influencia de la infusión reducida de glutatión en el metabolismo de la glucosa en pacientes con diabetes mellitus no insulinodependiente. Metabolismo. 1998; 47 : 993–997. [ PubMed ] [ Google Scholar ]
-
Dickinson DA, Levonen AL, Moellering DR, Arnold EK, Zhang H, Darley-Usmar VM, Forman HJ. Regulación del gen de la glutamato cisteína ligasa humana a través del elemento de respuesta electrófila. Radic Libre. Biol. Medicina. 2004; 37 : 1152–1159. [ PubMed ] [ Google Scholar ]
-
Do KQ, Trabesinger AH, Kirsten-Krüger M, Lauer CJ, Dydak U, Hell D, Holsboer F, Boesiger P, Cuénod M. Esquizofrenia: déficit de glutatión en el líquido cefalorraquídeo y la corteza prefrontal in vivo . EUR. J. Neurosci. 2000; 12 : 3721–3728. [ PubMed ] [ Google Scholar ]
-
Duh EJ, Maury WJ, Folks TM, Fauci AS, Rabson AB. El factor alfa de necrosis tumoral activa el virus de inmunodeficiencia humana tipo 1 mediante la inducción de la unión del factor nuclear a los sitios NF-kappa B en la repetición terminal larga. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1989; 86 : 5974–5978. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Duijvestijn YC, marca PL. Revisión sistemática de la N-acetilcisteína en la fibrosis quística. Acta Paediatr. 1999; 88 : 38–41. [ PubMed ] [ Google Scholar ]
-
Eisen M, Kaur S, Rehema A, Kullisaar T, Vihalemm T, Zilmer K, Kairane C, Zilmer M. La dermatitis alérgica de contacto se acompaña de cambios anormales severos en la antioxidatividad de la sangre. Biomed. Farmacista 2004; 58 : 260–263. [ PubMed ] [ Google Scholar ]
-
Ellerby LM, Ellerby HM, Park SM, Holleran AL, Murphy AN, Fiskum G, Kane DJ, Testa MP, Kayalar C, Bredesen DE. Desplazamiento del potencial celular de oxidación-reducción en las células neurales que expresan Bcl-2. J. Neurochem. 1996; 67 : 1259-1267. [ PubMed ] [ Google Scholar ]
-
Emdin M, Pompella A, Paolicchi A. Gamma-glutamiltransferasa, aterosclerosis y enfermedad cardiovascular: desencadenando el estrés oxidativo dentro de la placa. Circulación. 2005; 112 : 2078-2080. [ PubMed ] [ Google Scholar ]
-
Eneli I, Sadri K, Camargo C, Jr, Barr RG. El acetaminofén y el riesgo de asma: la evidencia epidemiológica y fisiopatológica. Cofre. 2005; 127 : 604–612. [ PubMed ] [ Google Scholar ]
-
Esposito F, Agosti V, Morrone G, Morra F, Cuomo C, Russo T, Venuta S, Cimino F. Inhibición de la diferenciación de líneas celulares mieloides humanas por cambios redox inducidos por el agotamiento del glutatión. Biochem. J. 1994; 301 : 649-653. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Estrela JM, Ortega A, Obrador E. Glutatión en biología y terapia del cáncer. Crit. Rev. Clin. Lab Sci. 2006; 43 : 143-181. [ PubMed ] [ Google Scholar ]
-
Fadeel B, Orrenius S, Zhivotovsky B. Apoptosis en la enfermedad humana: ¿una nueva piel para la antigua ceremonia? Biochem. Biophys Res. Commun. 1999; 6 : 699–717. [ PubMed ] [ Google Scholar ]
-
Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI. El papel central del glutatión en la fisiopatología de las enfermedades humanas. Arco. Physiol Biochem. 2007; 113 : 234–258. [ PubMed ] [ Google Scholar ]
-
Gao L, Broughman JR, Iwamoto T, Tomich JM, Venglarik CJ, Forman HJ. El canal de cloruro sintético restaura la secreción de glutatión en los epitelios de las vías respiratorias de fibrosis quística. Am J Physiol Células Pulmonares Mol Physiol. 2001; 281 : L24 – L30. [ PubMed ] [ Google Scholar ]
-
Gao L, Broughman JR, Iwamoto T, Tomich JM, Venglarik CJ, Forman HJ. El canal de cloruro sintético restaura la secreción de glutatión en los epitelios de las vías respiratorias de fibrosis quística. A.m. J. Physiol. Célula pulmonar. Mol. Physiol 2001; 281 : L24 – L30. [ PubMed ] [ Google Scholar ]
-
García-Ruiz C, Fernández-Checa JC. Regulación redox de la apoptosis de hepatocitos. J. Gastroenterol. Hepatol. 2007; 22 : S38 – S42. [ PubMed ] [ Google Scholar ]
-
Gegg ME, Beltrán B, Salas-Pino S, Bolaños JP, Clark JB, Moncada S, Heales SJ. Efecto diferencial del óxido nítrico sobre el metabolismo del glutatión y la función mitocondrial en los astrocitos y las neuronas: ¿implicaciones para la neuroprotección / neurodegeneración? J. Neurochem. 2003; 86 : 228–237. [ PubMed ] [ Google Scholar ]
-
Ghezzi P, Di Simplicio P. Vías de glutatión en la respuesta al fármaco. Curr Opin Pharmacol. 2007; 7 : 398–403. [ PubMed ] [ Google Scholar ]
-
Ghibelli L, Fanelli C, Rotilio G, Lafavia E, Coppola S, Colussi C, Civitareale P, Ciriolo MR. Rescate de células de la apoptosis por inhibición de la extrusión activa de GSH. Faseb J. 1998; 12 : 479-486. [ PubMed ] [ Google Scholar ]
-
Giral P, Jacob N, Dourmap C, Hansel B, Carrié A, Bruckert E, Girerd X, Chapman MJ. La actividad elevada de gamma-glutamiltransferasa y el perfil de tiol perturbado están asociados con las características del síndrome metabólico. Arterioscler. Trombo Vasc. Biol. 2008; 28 : 587–593. [ PubMed ] [ Google Scholar ]
-
Goven D, Boutten A, Le "on-Malas V, Marchal-Sommé J, Amara N, Crestani B, Fournier M, Lesèche G, Soler P, Boczkowski J, Bonay M. Alterado Nrf2 / Keap1-Bach1 equilibrio en el enfisema pulmonar. tórax. 2008; 63 :. 916-924 [ PubMed ] [ Google Académico ]
-
Grasemann H, Gaston B, Fang K, Paul K, Ratjen F. Disminución de los niveles de nitrosotioles en las vías respiratorias inferiores de pacientes con fibrosis quística y función pulmonar normal. J. Pediatr. 1999; 135 : 770–772. [ PubMed ] [ Google Scholar ]
-
Griese M, Ramakers J, Krasselt A, Starosta V, Van Koningsbruggen S, Fischer R, Ratjen F, Müllinger B, Huber RM, Maier K, Rietschel E, Scheuch G. Mejora del glutatión alveolar y la función pulmonar, pero no el estado oxidativo en quístico fibrosis. A.m. J. Respir. Crit. Care Med. 2004; 169 : 822–828. [ PubMed ] [ Google Scholar ]
-
Gu M, Owen AD, Toffa SE, Cooper JM, Dexter DT, Jenner P, Marsden CD, Schapira AH. Función mitocondrial, GSH y hierro en neurodegeneración y enfermedades del cuerpo de Lewy. J. Neurol. Sci. 1998; 158 : 24-29. [ PubMed ] [ Google Scholar ]
-
Guo N, McIntosh C, Shaw C. Glutatión: nuevo neuropéptido candidato en el sistema nervioso central. Neurociencia 1992; 51 : 835–842. [ PubMed ] [ Google Scholar ]
-
Hadzic T, Li L, Cheng N, Walsh SA, Spitz DR, Knudson CM. El papel de los tioles de bajo peso molecular en la proliferación de linfocitos T y la secreción de IL-2. J. Immunol. 2005; 175 : 7965-7972. [ PubMed ] [ Google Scholar ]
-
Hahn R, Wendel A, Flohe L. El destino del glutatión extracelular en la rata. Biochim Biophys Acta 1978; 539 : 324–337. [ PubMed ] [ Google Scholar ]
-
Hamilos DL, Zelarney P, Mascali JJ. Proliferación de linfocitos en linfocitos empobrecidos en glutatión: relación directa entre la disponibilidad de glutatión y la respuesta proliferativa. Inmunofarmacología. 1989; 18 : 223–235. [ PubMed ] [ Google Scholar ]
-
Hammond CL, Lee TK, Ballatori N. Nuevas funciones para el glutatión en la expresión génica, muerte celular y transporte de membranas de solutos orgánicos. J. Hepatol. 2001; 34 : 946–954. [ PubMed ] [ Google Scholar ]
-
Hammond CL, Madejczyk MS, Ballatori N. La activación de la membrana plasmática redujo el transporte de glutatión en la apoptosis del receptor de muerte de las células HepG2. Toxicol Appl. Pharmacol 2004; 195 : 12–22. [ PubMed ] [ Google Scholar ]
-
Hammond CL, Marchan R, Krance SM, Ballatori N. La exportación de glutatión durante la apoptosis requiere proteínas funcionales asociadas a la resistencia a múltiples fármacos. J. Biol. Chem 2007; 282 : 14337–14347. [ PubMed ] [ Google Scholar ]
-
Han J, Cheng FC, Yang Z, Dryhurst G. Los inhibidores de la respiración mitocondrial, el hierro (II) y los radicales hidroxilo evocan la liberación y la hidrólisis extracelular de glutatión en el estriado de la rata y la sustancia negra: implicaciones potenciales para la enfermedad de Parkinson. J. Neurochem. 1999; 73 : 1683-1695. [ PubMed ] [ Google Scholar ]
-
Hansen JM, Carney EW, Harris C. Diferenciación alterada en cultivos de micromass de yema de rata y conejo por agentes moduladores de glutatión. Radic Libre. Biol. Medicina. 2001; 31 : 1582-1592. [ PubMed ] [ Google Scholar ]
-
Harding JJ. Glutatión libre y unido a proteínas en lentes humanas normales y cataratas. Biochem. J. 1970; 117 : 957–960. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Hassan MQ, Hadi RA, Al-Rawi ZS, Padron VA, Stohs SJ. El sistema de defensa del glutatión en la patogénesis de la artritis reumatoide. J. Appl. Toxicol 2001; 21 : 69-73. [ PubMed ] [ Google Scholar ]
-
Hayashi A, Suzuki H, Itoh K, Yamamoto M, Sugiyama Y. Se requiere el factor de transcripción Nrf2 para la expresión constitutiva e inducible de la proteína 1 asociada a la resistencia a múltiples fármacos en fibroblastos de embrión de ratón. Biochem. Biophys Res. Commun. 2003; 310 : 824–829. [ PubMed ] [ Google Scholar ]
-
Jefe KA. Terapias naturales para trastornos oculares, segunda parte: cataratas y glaucoma. Altern Medicina. Rev. 2001; 6 : 141-166. [ PubMed ] [ Google Scholar ]
-
Herzenberg LA, De Rosa SC, Dubs JG, Roederer M, Anderson MT, Ela SW, Deresinski SC, Herzenberg LA. La deficiencia de glutatión se asocia con una supervivencia deteriorada en la enfermedad del VIH. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1997; 94 : 1967-1972. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Hinchman CA, Ballatori N. Capacidades de degradación del glutatión del hígado y el riñón en diferentes especies. Biochem. Pharmacol 1990; 40 : 1131-1135. [ PubMed ] [ Google Scholar ]
-
Hinchman CA, Ballatori N. La conjugación y conversión de glutatión a ácidos mercaptúricos puede ocurrir como un proceso intrahepático. J. Toxicol. Reinar. Salud. 1994; 41 : 387–409. [ PubMed ] [ Google Scholar ]
-
Hinchman CA, Matsumoto H, Simmons TW, Ballatori N. Conversión intrahepática de un conjugado de glutatión a su ácido mercaptúrico. J. Biol. Chem 1991; 266 : 22179–22185. [ PubMed ] [ Google Scholar ]
-
Hinchman CA, Truong AT, Ballatori N. Captación hepática de conjugado de glutatión S intacto, inhibición por aniones orgánicos y catabolismo sinusoidal. A.m. J. Physiol. 1993; 265 : G547 – G554. [ PubMed ] [ Google Scholar ]
-
Hinchman CA, Rebbeor JF, Ballatori N. Captación hepática eficiente y excreción biliar concentrada de un ácido mercaptúrico. A.m. J. Physiol. 1998; 275 : G612 – G619. [ PubMed ] [ Google Scholar ]
-
Hirrlinger J, Konig J, Dringen R. Expresión de ARNm de proteínas de resistencia a múltiples fármacos (Mrps) en astrocitos de rata cultivados, oligodendrocitos, células microgliales y neuronas. J. Neurochem. 2002a; 82 : 716–719. [ PubMed ] [ Google Scholar ]
-
Hirrlinger J, Schulz JB, Dringen R. Efectos de la dopamina en el metabolismo del glutatión de las células astrogliales cultivadas: implicaciones para la enfermedad de Parkinson. J. Neurochem. 2002b; 82 : 458-467. [ PubMed ] [ Google Scholar ]
-
Hirrlinger J, Schulz JB, Dringen R. Liberación de glutatión de las células cerebrales cultivadas: la proteína de resistencia a múltiples fármacos 1 media la liberación de GSH de las células astrogliales de rata. J. Neurosci. Res. 2002c; 69 : 318–326. [ PubMed ] [ Google Scholar ]
-
Hochman A, Sternin H, Gorodin S, Korsmeyer S, Ziv I, Melamed E, Offen D. Mayor estrés oxidativo y antioxidantes alterados en cerebros de ratones con deficiencia de Bcl-2. J. Neurochem. 1998; 71 : 741–748. [ PubMed ] [ Google Scholar ]
-
Hockenbery DM, Oltvai ZN, Yin XM, Milliman CL, Korsmeyer SJ. Bcl-2 funciona en una vía antioxidante para prevenir la apoptosis. Célula. 1993; 75 : 241–251. [ PubMed ] [ Google Scholar ]
-
Holleschau AM, Rathbun WB. Los efectos de la edad sobre las actividades de glutatión peroxidasa y glutatión reductasa en lentes de simios y prosimios del viejo mundo. Curr. Eye Res. 1994; 13 : 331-336. [ PubMed ] [ Google Scholar ]
-
Horwitz DA, Gray JD, Behrendsen SC, Kubin M, Rengaraju M, Ohtsuka K, Trinchieri G. Disminución de la producción de interleucina-12 y otras citocinas de tipo Th1 en pacientes con lupus eritematoso sistémico de reciente aparición. Artritis Rheum. 1998; 41 : 838–844. [ PubMed ] [ Google Scholar ]
-
Howard M, Fischer H, Roux J, Santos BC, Gullans SR, Yancey PH, Welch WJ. Los osmolitos de mamíferos y el S-nitrosoglutatión promueven la maduración y función de la proteína del regulador de conductancia transmembrana (CFTR) de la fibrosis quística Delta F508. J. Biol. Chem 2003; 278 : 35159–35167. [ PubMed ] [ Google Scholar ]
-
Hudson VM. Repensar la patología de la fibrosis quística: el papel crítico del transporte anormal de glutatión reducido (GSH) causado por la mutación CFTR. Radic Libre. Biol. Medicina. 2001; 30 : 1440–1461. [ PubMed ] [ Google Scholar ]
-
Huh YJ, Kim JM, Kim H, Song H, So H, Lee SY, Kwon SB, Kim HJ, Kim HH, Lee SH, Choi Y, Chung SC, Jeong DW, Min BM. Regulación de la diferenciación de osteoclastos mediante la modulación dependiente de redox de la importación nuclear de factores de transcripción. La muerte celular difiere. 2005; 13 : 1138–1146. [ PubMed ] [ Google Scholar ]
-
Hurbain I, Sermet-Gaudelus I, Vallee B, Feuillet MN, Lenoir G, Bernaudin JF, Edelman A, Fajac A. Evaluación de la expresión del gen MRP1-5 en pacientes con fibrosis quística homocigotos para la mutación delta F508. Pediatra Res. 2003; 54 : 627-634. [ PubMed ] [ Google Scholar ]
-
Iantomasi T, Favilli F, Catarzi S, Vincenzini MT. Papel de GSH en la fosforilación de tirosina del receptor del factor de crecimiento derivado de plaquetas inducida por H2O2. Biochem. Biophys Res. Commun. 2001; 280 : 1279-1285. [ PubMed ] [ Google Scholar ]
-
Ikeda Y, Taniguchi N. Expresión génica de gamma-glutamiltranspeptidasa. Métodos Enzymol. 2005; 401 : 408-425. [ PubMed ] [ Google Scholar ]
-
Isaacs J, Binkley F. Control dependiente de glutatión del contenido de disulfuro-sulfhidrilo de proteínas por fracciones subcelulares de tejido hepático. Biochim Biophys Acta 1977; 497 : 192-204. [ PubMed ] [ Google Scholar ]
-
Isomura H, Fujie K, Shibata K, Inoue N, Iizuka T, Takebe G, Takahashi K, Nishihira J, Izumi H, Sakamoto W. Metabolismo óseo y estrés oxidativo en ratas posmenopáusicas con sobrecarga de hierro. Toxicología. 2004; 197 : 93–100. [ PubMed ] [ Google Scholar ]
-
Jacobsen JP, Rodriguiz RM, Mørk A, Wetsel WC. Desregulación monoaminérgica en ratones con deficiencia de glutatión: ¿posible relevancia para la esquizofrenia? Neurociencia 2005; 132 : 1055-1072. [ PubMed ] [ Google Scholar ]
-
Jaiswal AK. Señalización de Nrf2 en la activación coordinada de la expresión del gen antioxidante. Radic Libre. Biol. Medicina. 2004; 36 : 1199–1207. [ PubMed ] [ Google Scholar ]
-
Janáky R, Ogita K, Pasqualotto BA, Bains JS, Oja SS, Yoneda Y, Shaw CA. Glutatión y transducción de señales en el SNC de mamíferos. J. Neurochem. 1999; 73 : 889-902. [ PubMed ] [ Google Scholar ]
-
Janáky R, Shaw CA, Varga V, Hermann A, Dohovics R, Saransaari P, Oja SS. Sitios específicos de unión al glutatión en membranas sinápticas corticales cerebrales de cerdo. Neurociencia 2000; 95 : 617-624. [ PubMed ] [ Google Scholar ]
-
Janáky R, Dohovics R, Saransaari P, Oja SS. Modulación de la liberación de [3H] dopamina por glutatión en cortes estriatales de ratón. Neuroquímica Res. 2007; 32 : 1357–1364. [ PubMed ] [ Google Scholar ]
-
Jang JH, Surh YJ. La atenuación de Bcl-2 de la muerte celular oxidativa se asocia con la regulación positiva de la ligasa de gamma-glutamilcisteína a través de la activación constitutiva de NF-kappaB. J. Biol. Chem 2004; 279 : 38779–38786. [ PubMed ] [ Google Scholar ]
-
Januel C, Fay LB, Ruggiero D, Lagarde M, Véricel E. Acoplamiento covalente de glutatión reducido con ribosa: pérdida de la capacidad del cosustrato de la glutatión peroxidasa. Biochim Biophys Acta 2003; 1620 : 125-132. [ PubMed ] [ Google Scholar ]
-
Jenner P. Estrés oxidativo en la enfermedad de Parkinson. Ana. Neurol 2003; 53 : S26 – S36. [ PubMed ] [ Google Scholar ]
-
Jiang H, Talaska AE, Schacht J, Sha SH. Desequilibrio oxidativo en el envejecimiento del oído interno. Neurobiol Envejecimiento. 2007; 28 : 1605-1612. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Jones DP. Redefiniendo el estrés oxidativo. Antioxido Señal redox. 2006; 8 : 1865-1879. [ PubMed ] [ Google Scholar ]
-
Jösch C, Klotz LO, Sies H. Identificación de la leucil aminopeptidasa citosólica (EC 3.4.11.1) como la principal actividad de hidrolización de cisteinilglicina en el hígado de rata. Biol. Chem 2003; 384 : 213–218. [ PubMed ] [ Google Scholar ]
-
Jun JH, Lee SH, Kwak HB, Lee ZH, Seo SB, Woo KM, Ryoo HM, Kim GS, Baek JH. La N-acetilcisteína estimula la diferenciación osteoblástica de las células calvariales de ratón. J. Cell Biochem. 2008; 103 : 1246-1255. [ PubMed ] [ Google Scholar ]
-
Kabesch M, Hoefler C, Carr D, Leupold W, Weiland SK, von Mutius E. La deficiencia de glutatión S transferasa y el tabaquismo pasivo aumentan el asma infantil. Tórax. 2004; 59 : 569–573. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Kaneto H, Kajimoto Y, Miyagawa J, Matsuoka T, Fujitani Y, Umayahara Y, Hanafusa T, Matsuzawa Y, Yamasaki Y, Hori M. Efectos beneficiosos de los antioxidantes en la diabetes: posible protección de las células beta pancreáticas contra la toxicidad de la glucosa. Diabetes. 1999; 48 : 2398–2406. [ PubMed ] [ Google Scholar ]
-
Kaneto H, Katakami N, Kawamori D, Miyatsuka T, Sakamoto K, Matsuoka TA, Matsuhisa M, Yamasaki Y. Implicación del estrés oxidativo en la patogénesis de la diabetes. Antioxido Señal redox. 2007; 9 : 355–366. [ PubMed ] [ Google Scholar ]
-
Katakura K, Kishida K, Hirano H. Cambios en las proteínas de la lente de la rata y la actividad de la glutatión reductasa con la edad avanzada. En t. J. Vitam. Nutr. Res. 2004; 74 : 329–333. [ PubMed ] [ Google Scholar ]
-
Kemp M, Go YM, Jones DP. Termodinámica sin equilibrio de los sistemas redox de tiol / disulfuro: una perspectiva sobre la biología de los sistemas redox. Radic Libre. Biol. Medicina. 2008; 44 : 921–937. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Kerrigan-Baumrind LA, Quigley HA, Pease ME, Kerrigan DF, Mitchell RS. Número de células ganglionares en los ojos de glaucoma en comparación con las pruebas de campo visual umbral en las mismas personas. Invertir. Oftalmol Vis. Sci. 2000; 41 : 741–748. [ PubMed ] [ Google Scholar ]
-
Kidd P. Th1 / Th2 balance: la hipótesis, sus limitaciones e implicaciones para la salud y la enfermedad. Altern Medicina. Rev. 2003; 8 : 223–246. [ PubMed ] [ Google Scholar ]
-
Kim JM, Kim H, Kwon SB, Lee SY, Chung SC, Jeong DW, Min BM. El estado de glutatión intracelular regula la diferenciación de macrófagos y la actividad fagocítica derivada de monocitos derivados de la médula ósea de ratón. Biochem. Biophys Res. Commun. 2004; 325 : 101-108. [ PubMed ] [ Google Scholar ]
-
Kim SK, Woodcroft KJ, Novak RF. Regulación de insulina y glucagón de la expresión de glutatión S-transferasa en hepatocitos de rata cultivados primarios. J. Pharmacol. Exp. El r. 2003; 305 : 353–361. [ PubMed ] [ Google Scholar ]
-
Kim SK, Woodcroft KJ, Khodadadeh SS, Novak RF. La señalización de insulina regula la expresión de la subunidad catalítica de la gamma-glutamilcisteína ligasa en hepatocitos de rata cultivados primarios. J. Pharmacol. Exp. El r. 2004; 311 : 99-108. [ PubMed ] [ Google Scholar ]
-
Kinnula VL, Vuorinen K, Ilumets H, Rytilä P, Myllärniemi M. Proteínas de tiol, modulación redox y enfermedad pulmonar parenquimatosa. Curr. Medicina. Chem 2007; 14 : 213–222. [ PubMed ] [ Google Scholar ]
-
Caballero JA. La bioquímica del envejecimiento. Adv. Clin. Chem 2000; 35 : 1–62. [ PubMed ] [ Google Scholar ]
-
Kode A, Rajendrasozhan S, Caito S, Yang SR, Megson IL, Rahman I. El resveratrol induce la síntesis de glutatión mediante la activación de Nrf2 y protege contra el estrés oxidativo mediado por el humo del cigarrillo en las células epiteliales del pulmón humano. A.m. J. Physiol. Célula pulmonar. Mol. Physiol 2008; 294 : L478 – L488. [ PubMed ] [ Google Scholar ]
-
Kogan I, Ramjeesingh M, Huan LJ, Wang Y, Bear CE. La perturbación del poro del regulador de conductancia transmembrana de la fibrosis quística (CFTR) inhibe su actividad atpasa. J Biol. Chem 2001; 276 : 11575-11581. [ PubMed ] [ Google Scholar ]
-
Kogan I, Ramjeesingh M, Li C, Kidd JF, Wang Y, Leslie EM, Cole SP, Bear CE. CFTR media directamente el flujo de glutatión regulado por nucleótidos. Embo J. 2003; 22 : 1981-1989. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Kokcam I, Naziroglu M. Estado de antioxidantes y peroxidación lipídica en la sangre de pacientes con psoriasis. Clin. Chim. Acta 1999; 289 : 23–31. [ PubMed ] [ Google Scholar ]
-
Kowaltowski AJ, Fiskum G. Mecanismos redox de citoprotección por Bcl-2. Señal redox antioxidante. 2005; 7 : 508-514. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Kruh GD, Belinsky MG, Gallo JM, Lee K.Funciones fisiológicas y farmacológicas de Mrp2, Mrp3 y Mrp4 según lo determinado por estudios recientes en ratones con genes alterados. Metástasis de cáncer. Rev. 2007; 26 : 5–14. [ PubMed ] [ Google Scholar ]
-
Kumar TR, Wiseman AL, Kala G, Kala SV, Matzuk MM, Lieberman MW. Defectos reproductivos en ratones deficientes en transpeptidasa gamma-glutamil. Endocrinología. 2000; 141 : 4270-4277. [ PubMed ] [ Google Scholar ]
-
Lang CA, Mills BJ, Mastropaolo W, Liu MC. El glutatión en sangre disminuye en enfermedades crónicas. J. Lab. Clin. Medicina. 2000; 135 : 402–405. [ PubMed ] [ Google Scholar ]
-
Lang CA, Naryshkin S, Schneider DL, Mills BJ, Lindeman RD. Niveles bajos de glutatión en sangre en adultos sanos que envejecen. J. Lab. Clin. Medicina. 1992; 120 : 720–725. [ PubMed ] [ Google Scholar ]
-
Lash LH. Transporte de glutatión mitocondrial: implicaciones fisiológicas, patológicas y toxicológicas. Chem Biol. Interactuar. 2006; 163 : 54–67. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Lauterburg BH, Adams JD, Mitchell JR. Homeostasis hepática del glutatión en la rata: el flujo de salida representa el recambio de glutatión. Hepatología 1984; 4 : 586–590. [ PubMed ] [ Google Scholar ]
-
Lavoie S, y col. El precursor de glutatión, la N-acetil-cisteína, mejora la negatividad del desajuste en pacientes con esquizofrenia. Neuropsicofarmacología. 2008; 33 : 2187–2199. [ PubMed ] [ Google Scholar ]
-
Lean JM, Davies JT, Fuller K, Jagger CJ, Kirstein B, Partington GA, Urry ZL, Chambers TJ. Un papel crucial para los antioxidantes de tiol en la pérdida ósea por deficiencia de estrógenos. J. Clin. Invertir. 2003; 112 : 915–923. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Lee JM, Johnson JA. Un papel importante de la vía Nrf2-ARE en el mecanismo de defensa celular. J. Biochem. Mol. Biol. 2004; 37 : 139-143. [ PubMed ] [ Google Scholar ]
-
Lee NK, Choi YG, Baik JY, Han SY, Jeong DW, Bae YS, Kim N, Lee SY. Un papel crucial para las especies reactivas de oxígeno en la diferenciación de osteoclastos inducida por RANKL. Sangre. 2005; 106 : 852–859. [ PubMed ] [ Google Scholar ]
-
Leopold JA, Loscalzo J. Enzimopatías oxidativas y enfermedad vascular. Arterioscler. Trombo Vasc. Biol. 2005; 25 : 1332–1340. [ PubMed ] [ Google Scholar ]
-
Leslie SW, Brown LM, Trent RD, Lee YH, Morris JL, Jones TW, Randall PK, Lau SS, Monks TJ. Estimulación de la entrada de calcio mediada por el receptor de N-metil-D-aspartato en las neuronas disociadas por glutatión reducido y oxidado. Mol. Pharmacol 1992; 41 : 308–314. [ PubMed ] [ Google Scholar ]
-
Leslie EM, Deeley RG, Cole SPC. Proteínas de resistencia a múltiples fármacos: papel de la glicoproteína P, MRP1, MRP2 y BCRP (ABCG2) en la defensa de los tejidos. Tox. Appl. Pharm 2005; 204 : 216–237. [ PubMed ] [ Google Scholar ]
-
Li L, Lee TK, Meier PJ, Ballatori N. Identificación del glutatión como fuerza impulsora y leucotrieno C4 como sustrato para oatp1, el transportador hepático sinusoidal de solutos orgánicos. J. Biol. Chem 1998; 273 : 16184–16191. [ PubMed ] [ Google Scholar ]
-
Li C, Krishnamurthy PC, Penmatsa H, Marrs KL, Wang XQ, Zaccolo M, Jalink K, Li M, Nelson DJ, Schuetz JD, Naren AP. El acoplamiento espacio-temporal del transportador de AMPc a la función del canal de cloruro CFTR en el epitelio intestinal. Célula. 2007; 131 : 940–951. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Lieberman MW, Wiseman AL, Shi ZZ, Carter BZ, Barrios R, Ou CN, Chévez-Barrios P, Wang Y, Habib GM, Goodman JC, Huang SL, Lebovitz RM, Matzuk MM. Retraso del crecimiento y deficiencia de cisteína en ratones con deficiencia de gamma-glutamil transpeptidasa. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1996; 93 : 7923-7926. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Linsdell P, Hanrahan JW. Permeabilidad al glutatión de CFTR. A.m. J. Physiol. 1998; 275 : C323 – C326. [ PubMed ] [ Google Scholar ]
-
Liu H, Harrell LE, Shenvi S, Hagen T, Liu RM. Diferencias de género en el metabolismo del glutatión en la enfermedad de Alzheimer. J. Neurosci. Res. 2005; 79 : 861–867. [ PubMed ] [ Google Scholar ]
-
Liu H, Wang H, Shenvi S, Hagen TM, Liu RM. Metabolismo del glutatión durante el envejecimiento y en la enfermedad de Alzheimer. Ana. NY Acad. Sci. 2004; 1019 : 346–349. [ PubMed ] [ Google Scholar ]
-
Lorico A, Rappa G, Finch RA, Yang D, Flavell RA, Sartorelli AC. La interrupción del gen murino MRP (proteína de resistencia a múltiples fármacos) conduce a una mayor sensibilidad al etopósido (VP-16) y a mayores niveles de glutatión. Cancer Res. 1997; 57 : 5238-5242. [ PubMed ] [ Google Scholar ]
-
Lowry MH, McAllister BP, Jean JC, Brown LA, Hughey RP, Cruikshank WW, Amar S, Lucey EC, Braun K, Johnson P, Wight TN, Joyce-Brady M. El glutatión líquido del revestimiento pulmonar atenúa el asma inducida por IL-13. A.m. J. Respir. Célula. Mol. Biol. 2008; 38 : 509-516. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Lu SC, Ge JL, Kuhlenkamp J, Kaplowitz N. Dependencia de insulina y glucocorticoides de la síntesis hepática de gamma-glutamilcisteína sintetasa y síntesis de glutatión en la rata. Estudios en hepatocitos cultivados e in vivo . J. Clin. Invertir. 1992; 90 : 524-532. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Lu SC, Kuhlenkamp J, Wu H, Sun WM, Stone L, Kaplowitz N. Defecto progresivo en la secreción biliar de GSH en ratas diabéticas inducidas por estreptozotocina. A.m. J. Physiol. 1997; 272 : G374 – G382. [ PubMed ] [ Google Scholar ]
-
Lu SC, Bao Y, Huang ZZ, Sarthy VP, Kannan R. Regulación de la expresión génica de la subunidad gamma-glutamilcisteína sintetasa en células de Müller retinianas por estrés oxidativo. Invierta oftalmol. Vis. Sci. 1999; 40 : 1776-1782. [ PubMed ] [ Google Scholar ]
-
Maggio D, Barabani M, Pierandrei M, Polidori MC, Catani M, Mecocci P, Senin U, Pacifici R, Cherubini A. Disminución marcada de antioxidantes plasmáticos en mujeres osteoporóticas de edad avanzada: Resultados de un estudio transversal. J. Clin. Endocrinol Metab. 2003; 88 : 1523-1527. [ PubMed ] [ Google Scholar ]
-
Mahagita C, Grassl SM, Piyachaturawat P, Ballatori N. El transportador de aniones orgánicos humanos 1B1 (OATP1B1 / OATP-C) y 1B3 (OATP1B3 / OATP-8) funcionan como portadores bidireccionales y no median el co-transporte de ácidos biliares GSH. A.m. J. Physiol. 2007; 293 : G271 – G278. [ PubMed ] [ Google Scholar ]
-
Maher P, Hanneken A. Los flavonoides protegen las células ganglionares de la retina de la muerte inducida por el estrés oxidativo. Invertir. Oftalmol Vis. Sci. 2005; 46 : 4796-4803. [ PubMed ] [ Google Scholar ]
-
Malhotra D, Thimmulappa R, Navas-Acien A, Sandford A, Elliott M, Singh A, Chen L, Zhuang X, Hogg J, Pare P, Tuder RM, Biswal S. Disminución de antioxidantes regulados por NRF2 en pulmones con enfermedad pulmonar obstructiva crónica debido a la pérdida de su regulador positivo, DJ-1. Soy J. Respir. Crit. Care Med. 2008; 178 : 592–604. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] Retraído
-
Marrades RM, Roca J, Barberà JA, de Jover L, MacNee W, Rodriguez-Roisin R. El glutatión nebulizado induce broncoconstricción en pacientes con asma leve. A.m. J. Respir. Crit. Care Med. 1997; 156 : 425-430. [ PubMed ] [ Google Scholar ]
-
Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Nuevos mecanismos de compuestos antioxidantes naturales en sistemas biológicos: implicación de glutatión y enzimas relacionadas con el glutatión. J. Nutr. Biochem. 2005; 16 : 577–586. [ PubMed ] [ Google Scholar ]
-
Mastrocola R, Restivo F, Vercellinatto I, Danni O, Brignardello E, Aragno M, Boccuzzi G. Estrés oxidativo y nitrosativo en las mitocondrias cerebrales de ratas diabéticas. J. Endocrinol. 2005; 187 : 37–44. [ PubMed ] [ Google Scholar ]
-
Mayatepek E, Badiou S, Bellet H, Lehmann WD. Un paciente con síntomas neurológicos y metabolismo anormal de leucotrienos: un nuevo defecto en la biosíntesis de leucotrienos. Ana. Neurol 2005; 58 : 968–970. [ PubMed ] [ Google Scholar ]
-
McCullough KD, Martindale JL, Klotz LO, Aw TY, Holbrook NJ. Gadd153 sensibiliza a las células al estrés del retículo endoplásmico mediante la regulación negativa de Bcl2 y perturbando el estado redox celular. Mol. Cell Biol. 2001; 21 : 1249-1259. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
McFadden SL, Ding D, Salvi R. Aspectos anatómicos, metabólicos y genéticos de la pérdida auditiva relacionada con la edad en ratones. Audiología 2001; 40 : 313–321. [ PubMed ] [ Google Scholar ]
-
McFadden SL, Ding D, Reaume AG, Flood DG, Salvi RJ. La pérdida de células ciliadas cocleares relacionada con la edad aumenta en ratones que carecen de superóxido dismutasa de cobre / zinc. Neurobiol Envejecimiento. 1999a; 20 : 1–8. [ PubMed ] [ Google Scholar ]
-
McFadden SL, Ding D, Burkard RF, Jiang H, Reaume AG, Flood DG, Salvi RJ. La deficiencia de Cu / Zn SOD potencia la pérdida auditiva y la patología coclear en ratones CD-1 de 129 años. J. Comp. Neurol 1999b; 413 : 101-112. [ PubMed ] [ Google Scholar ]
-
McKeever TM, Lewis SA, Smit HA, Burney P, Britton JR, Cassano PA. La asociación de acetaminofén, aspirina e ibuprofeno con enfermedad respiratoria y función pulmonar. A.m. J. Respir. Crit. Care Med. 2005; 171 : 966–971. [ PubMed ] [ Google Scholar ]
-
McLennan SV, Heffernan S, Wright L, Rae C, Fisher E, Yue DK, Turtle JR. Cambios en el metabolismo hepático del glutatión en la diabetes. Diabetes. 1991; 40 : 344–348. [ PubMed ] [ Google Scholar ]
-
Meister A. Nuevos desarrollos en el metabolismo del glutatión y su posible aplicación en la terapia. Hepatología 1984; 4 : 739–742. [ PubMed ] [ Google Scholar ]
-
Meister A, Anderson ME. Glutatión Annu Rev. Biochem. 1983; 52 : 711–760. [ PubMed ] [ Google Scholar ]
-
Meister A, Tate SS. Glutatión y compuestos gamma-glutamil relacionados: biosíntesis y utilización. Annu Rev. Biochem. 1976; 45 : 559–604. [ PubMed ] [ Google Scholar ]
-
Meredith MJ, Cusick CL, Soltaninassab S, Sekhar KS, Lu S, Freeman ML. La expresión de Bcl-2 aumenta el glutatión intracelular al inhibir el flujo de salida de GSH dependiente de metionina. Biochem. Biophys Res. Commun. 1998; 248 : 458–463. [ PubMed ] [ Google Scholar ]
-
Messina JP, Lawrence DA. La progresión del ciclo celular de las células mononucleares de sangre periférica humana con depleción de glutatión se inhibe en la fase S. J. Immunol. 1989; 143 : 1974-1981. [ PubMed ] [ Google Scholar ]
-
Mieyal JJ, Gallogly MM, Qanungo S, Sabens EA, Shelton MD. Mecanismos moleculares e implicaciones clínicas de la proteína reversible S- glutatión. Señal redox antioxidante. 2008; 10 : 1941–1988. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Moreno MC, Campanelli J, Sande P, Sanez DA, Keller Sarmiento MI, Rosenstein RE. Estrés oxidativo retiniano inducido por alta presión intraocular. Radic Libre. Biol. Medicina. 2004; 37 : 803–812. [ PubMed ] [ Google Scholar ]
-
Moriarty-Craige SE, Adkison J, Lynn M, Gensler G, Bressler S, Jones DP, Sternberg P., Jr Los suplementos antioxidantes previenen la oxidación de la cisteína / cistina redox en pacientes con degeneración macular relacionada con la edad. A.m. J. Ophthalmol. 2005; 140 : 1020-1026. [ PubMed ] [ Google Scholar ]
-
Motohashi H, Yamamoto M. Nrf2-Keap1 define un mecanismo de respuesta al estrés fisiológicamente importante. Tendencias Mol Med. 2004; 10 : 549–557. [ PubMed ] [ Google Scholar ]
-
Murata Y, Shimamura T, Hamuro J. La polarización del equilibrio T (h) 1 / T (h) 2 depende del estado intracelular de tiol redox de los macrófagos debido a la producción distintiva de citocinas. En t. Immunol 2002; 14 : 201–212. [ PubMed ] [ Google Scholar ]
-
Mustelin T, Vang T, Bottini N. Proteína tirosina fosfatasas y la respuesta inmune. Nat. Rev. Immunol. 2005; 5 : 43–57. [ PubMed ] [ Google Scholar ]
-
Nencioni L, Iuvara A, Aquilano K, Ciriolo MR, Cozzolino F, Rotilio G, Garaci E, Palamara AT. La replicación del virus de la influenza A depende de una vía antioxidante que involucra GSH y Bcl-2. Faseb J. 2003; 17 : 758–760. [ PubMed ] [ Google Scholar ]
-
Njålsson R, Norgren S. Aspectos fisiológicos y patológicos del metabolismo de GSH. Acta Paediatr. 2005; 94 : 132-137. [ PubMed ] [ Google Scholar ]
-
Nkabyo YS, Ziegler TR, Gu LH, Watson WH, Jones DP. Glutatión y tiorredoxina redox durante la diferenciación en células epiteliales de colon humano (Caco-2). A.m. J. Physiol. Gastrointest. Hígado Physiol. 2002; 283 : G1352 – G1359. [ PubMed ] [ Google Scholar ]
-
O'Brien ML, Tew KD. Glutatión y enzimas relacionadas en resistencia a múltiples fármacos. EUR. J. Cancer. 1996; 32 : 967–978. [ PubMed ] [ Google Scholar ]
-
Oda T, Sadakata N, Komatsu N, Muramatsu T. Salida específica de glutatión del dominio de membrana basolateral en células MDCK polarizadas durante la apoptosis inducida por ricina. J. Biochem. 1999; 126 : 715–721. [ PubMed ] [ Google Scholar ]
-
Odetti P, Pesce C, Traverso N, Menini S, Maineri EP, Cosso L, Valentini S, Patriarca S, Cottalasso D, Marinari UM, Pronzato MA. Ensayo comparativo de N-acetil-cisteína, taurina y oxerutina sobre el daño de la piel y los riñones en la diabetes experimental a largo plazo. Diabetes. 2003; 52 : 499–505. [ PubMed ] [ Google Scholar ]
-
Ogita K, Enomoto R, Nakahara F, Ishitsubo N, Yoneda Y. Un posible papel del glutatión como agonista endógeno en el dominio de reconocimiento de N-metil-D-aspartato en el cerebro de rata. J. Neurochem. 1995; 64 : 1088-1096. [ PubMed ] [ Google Scholar ]
-
Ohlemiller KK, McFadden SL, Ding DL, Lear PM, Ho YS. La mutación dirigida del gen para la glutatión peroxidasa celular (Gpx1) aumenta la pérdida auditiva inducida por ruido en ratones. J. Assoc. Res. Otolaryngol. 2000; 1 : 243–254. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Oja SS, Janáky R, Varga V, Saransaari P. Modulación de las funciones del receptor de glutamato por glutatión. Neuroquímica En t. 2000; 37 : 299–306. [ PubMed ] [ Google Scholar ]
-
Ortega A, Ferrer P, Carretero J, Obrador E, Asensi M, Pellicer JA, Estrela JM. La baja regulación de la síntesis de glutatión y Bcl-2 en células de melanoma B16 de ratón evita su supervivencia durante la interacción con el endotelio vascular. J. Biol. Chem 2003; 278 : 39591–39599. [ PubMed ] [ Google Scholar ]
-
Ozgocmen S, Kaya H, Fadillioglu E, Yilmaz Z. Efectos de la calcitonina, risedronato y raloxifeno sobre la actividad enzimática antioxidante de los eritrocitos, peroxidación lipídica y óxido nítrico en la osteoporosis posmenopáusica. Arco. Medicina. Res. 2007a; 38 : 196–205. [ PubMed ] [ Google Scholar ]
-
Ozgocmen S, Kaya H, Fadillioglu E, Aydogan R, Yilmaz Z. Papel de los sistemas antioxidantes, peroxidación lipídica y óxido nítrico en la osteoporosis posmenopáusica. Mol. Cell Biochem. 2007b; 295 : 45-52. [ PubMed ] [ Google Scholar ]
-
Palamara AT, Perno CF, Ciriolo MR, Dini L, Balestra E, D'Agostini C, Di Francesco P, Favalli C, Rotilio G, Garaci E. Evidencia de actividad antiviral del glutatión: inhibición in vitro de la replicación del virus del herpes simple tipo 1 . Res antivirales. 1995; 27 : 237–253. [ PubMed ] [ Google Scholar ]
-
Parker WD, Jr, Boyson SJ, Parks JK. Anormalidades de la cadena de transporte de electrones en la enfermedad de Parkinson idiopática. Ana. Neurol 1989; 26 : 719–723. [ PubMed ] [ Google Scholar ]
-
Pastore A, Federici G, Bertini E, Piemonte F. Análisis del glutatión: implicación en redox y desintoxicación. Clin. Chim. Acta 2003; 333 : 19–39. [ PubMed ] [ Google Scholar ]
-
Pau H, Graf P, Sies H. Contenido de glutatión de la lente en diversas formas de catarata. Graefes Arch. Clin. Exp. Oftalmol mil novecientos ochenta y dos; 219 : 140-142. [ PubMed ] [ Google Scholar ]
-
Pearce RK, Owen A, Daniel S, Jenner P, Marsden CD. Alteraciones en la distribución de glutatión en la sustancia negra en la enfermedad de Parkinson. J. Neural Transm. 1997; 104 : 661–677. [ PubMed ] [ Google Scholar ]
-
Perl A, Gergely P, Jr, Nagy G, Koncz A, Hiperpolarización mitocondrial de Banki K.: un punto de control de la vida, muerte y autoinmunidad de las células T. Tendencias Immunol. 2004; 25 : 360–367. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Perry TL, Yong VW, Bergeron C, Hansen S, Jones K.Actividad de aminoácidos, glutatión y glutatión transferasa en el cerebro de pacientes con enfermedad de Alzheimer. Ana. Neurol 1987; 21 : 331-336. [ PubMed ] [ Google Scholar ]
-
Peterson JD, Herzenberg LA, Vasquez K, Waltenbaugh C. Los niveles de glutatión en las células presentadoras de antígeno modulan los patrones de respuesta Th1 versus Th2. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1998; 95 : 3071–3076. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Pinnen F, Cacciatore I, Cornacchia C, Sozio P, Iannitelli A, Costa M, Pecci L, Nasuti C, Cantalamessa F, Di Stefano A. Síntesis y estudio de bacalaos de L-dopa-glutatión como nuevos agentes antiparkinsonianos con radicales libres propiedades de barrido. J. Med. Chem 2007; 50 : 2506-2515. [ PubMed ] [ Google Scholar ]
-
Prousky J. El tratamiento de enfermedades pulmonares y afecciones relacionadas con las vías respiratorias con glutatión inhalado (nebulizado o en aerosol). Evid Complemento Basado. Alternat. Medicina. 2008; 5 : 27–35. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Rabinovic AD, Hastings TG. Papel del glutatión endógeno en la oxidación de la dopamina. J. Neurochem. 1998; 71 : 2071-2078. [ PubMed ] [ Google Scholar ]
-
Rahman I. Regulación del glutatión en inflamación y enfermedades pulmonares crónicas. Mutat Res. 2005; 579 : 58-80. [ PubMed ] [ Google Scholar ]
-
Rebbeor JF, Connolly GC, Dumont ME, Ballatori N. Transporte dependiente de ATP de glutatión reducido en YCF1, el ortólogo de levadura de proteínas asociadas a la resistencia a múltiples fármacos de mamíferos. J. Biol. Chem 1998a; 273 : 33449–33454. [ PubMed ] [ Google Scholar ]
-
Rebbeor JF, Wang W, Clifton D, Ballatori N. Formación de glutatión S-conjugado y metabolismo en células HepG2: un modelo celular de biosíntesis de ácido mercaptúrico. J. Toxicol. Reinar. Salud. 1998b; 53 : 651–663. [ PubMed ] [ Google Scholar ]
-
Rebbeor JF, Connolly GC, Henson JH, Boyer JL, Ballatori N. GSP dependiente de ATP y transporte conjugado de glutatión S en el hígado del patín: papel de un homólogo funcional Mrp. A.m. J. Physiol. Gastrointest. Hígado Physiol. 2000; 279 : G417 – G425. [ PubMed ] [ Google Scholar ]
-
Rebbeor JF, Connolly GC, Ballatori N. Inhibición del transporte mediado por Mrp2 e Ycf1p mediante agentes reductores: evidencia de transporte de GSH en ratas Mrp2. Biochim Biophys Acta 2002; 1559 : 171-178. [ PubMed ] [ Google Scholar ]
-
Reynolds A, Laurie C, Lee Mosley R, Gendelman HE. El estrés oxidativo y la patogénesis de los trastornos neurodegenerativos. En t. Rev. Neurobiol. 2007; 82 : 297–325. [ PubMed ] [ Google Scholar ]
-
Rice ME, Russo-Menna I. Compartimentación diferencial de ascorbato cerebral y glutatión entre neuronas y glía. Neurociencia 1998; 82 : 1213-1223. [ PubMed ] [ Google Scholar ]
-
Richter C. Daño reactivo de oxígeno y ADN en las mitocondrias. Mutat Res. 1992; 275 : 249–255. [ PubMed ] [ Google Scholar ]
-
Rikans LE, Hornbrook KR. Peroxidación lipídica, protección antioxidante y envejecimiento. Biochim Biophys Acta 1997; 1362 : 116-127. [ PubMed ] [ Google Scholar ]
-
Riordan JR, Rommens JM, Kerem B, Alon N, Rozmahel R, Grzelczak Z, Zielenski J, Lok S, Plavsic N, Chou JL, Drumm ML, Iannuzzi MC, Collins FS, Tsui L. Identificación del gen de la fibrosis quística: clonación y caracterización de ADN complementario. Ciencias. 1989; 245 : 1066-1073. [ PubMed ] [ Google Scholar ]
-
Ristoff E, Larsson A. Errores innatos en el metabolismo del glutatión. Orphanet J. Rare Dis. 2007; 2 : 16. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Romagnani S. Th1 y Th2 en enfermedades humanas. Clin. Immunol Inmunopathol. 1996; 80 : 225–235. [ PubMed ] [ Google Scholar ]
-
Rosenblat M, Volkova N, Coleman R, Aviram M. Propiedades antioxidantes y antiaterogénicas del glutatión liposomal: estudios in vitro y en ratones con deficiencia de apolipoproteína aterosclerótica. La aterosclerosis. 2007; 195 : e61 – e68. [ PubMed ] [ Google Scholar ]
-
Roum JH, Buhl R, McElvaney NG, Borok Z, Crystal RG. Deficiencia sistémica de glutatión en la fibrosis quística. J. Appl. Physiol 1993; 75 : 2419–2424. [ PubMed ] [ Google Scholar ]
-
Roum JH, Borok Z, McElvaney NG, Grimes GJ, Bokser AD, Buhl R, Crystal RG. El aerosol de glutatión suprime los oxidantes derivados de células inflamatorias de la superficie epitelial pulmonar en la fibrosis quística. J. Appl. Physiol 1999; 87 : 438–443. [ PubMed ] [ Google Scholar ]
-
Sakamaki H, Akazawa S, Ishibashi M, Izumino K, Takino H, Yamasaki H, Yamaguchi Y, Goto S, Urata Y, Kondo T, Nagataki S. Importancia del sistema antioxidante dependiente de glutatión en las malformaciones embrionarias inducidas por la diabetes. Diabetes. 1999; 48 : 1138-1144. [ PubMed ] [ Google Scholar ]
-
Samiec PS, Drews-Botsch C, Flagg EW, Kurtz JC, Sternberg P, Jr, Reed RL, Jones DP. Glutatión en plasma humano: disminución en asociación con el envejecimiento, la degeneración macular relacionada con la edad y la diabetes. Radic Libre. Biol. Medicina. 1998; 24 : 699–704. [ PubMed ] [ Google Scholar ]
-
Sanchez-Rodriguez MA, Ruiz-Ramos M, Correa-Munoz E, Mendoza-Nunez VM. El estrés oxidativo como factor de riesgo de osteoporosis en mexicanos de edad avanzada, caracterizado por enzimas antioxidantes. BMC Musculoskelet. Desorden 2007; 8 : 124. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sanders KM, Kotowicz MA, Nicholson GC. Papel potencial del antioxidante N-acetilcisteína en la desaceleración de la resorción ósea en mujeres posmenopáusicas tempranas: un estudio piloto. Transl. Res. 2007; 150 : 215. [ PubMed ] [ Google Scholar ]
-
Sastre J, Martin JA, Gomez-Cabrera MC, Pereda J, Borras C, Pallardo FV, Vina J. El daño oxidativo asociado con la edad conduce a la ausencia de gamma-cistationionasa en más del 50% de los lentes de rata: relevancia en la cataractogénesis. Radic Libre. Biol. Medicina. 2005; 38 : 575–582. [ PubMed ] [ Google Scholar ]
-
Schafer FQ, Buettner GR. Entorno redox de la célula visto a través del estado redox de la pareja glutatión disulfuro / glutatión. Radic Libre. Biol. Medicina. 2001; 30 : 1191–1212. [ PubMed ] [ Google Scholar ]
-
Schapira AH, Cooper JM, Dexter D, Clark JB, Jenner P, Marsden CD. Deficiencia del complejo mitocondrial I en la enfermedad de Parkinson. J. Neurochem. 1990; 54 : 823–827. [ PubMed ] [ Google Scholar ]
-
Schor NF, Rudin CM, Hartman AR, Thompson CB, Tyurina YY, Kagan VE. Dependencia de la línea celular de la alteración inducida por Bcl-2 del manejo del glutatión. Oncogene 2000; 19 : 472–476. [ PubMed ] [ Google Scholar ]
-
Schwiebert EM, Benos DJ, Egan ME, Stutts MJ, Guggino WB. CFTR es un regulador de conductancia, así como un canal de cloruro. Physiol Rev. 1999; 79 : S145 – S166. [ PubMed ] [ Google Scholar ]
-
Seidman MD, Khan MJ, Tang WX, Quirk WS. Influencia de la lecitina en el ADN mitocondrial y la pérdida auditiva relacionada con la edad. Otolaryngol. Cabeza Cuello Surg. 2002; 127 : 138-144. [ PubMed ] [ Google Scholar ]
-
Seifried HE. Estrés oxidativo y antioxidantes: ¿un vínculo con la enfermedad y la prevención? J. Nutr. Biochem. 2007; 18 : 168-171. [ PubMed ] [ Google Scholar ]
-
Servetnyk Z, Krjukova J, Gaston B, Zaman K, Hjelte L, Roomans GM, Dragomir A. Activación del transporte de cloruro en las líneas celulares epiteliales de las vías respiratorias de la FQ y las células epiteliales nasales primarias de la FQ por S-nitrosoglutatión. Respir Res. 2006; 7 : 124. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sethna SS, Holleschau AM, Rathbun WB. Actividad de las enzimas de síntesis de glutatión en la lente humana relacionada con la edad. Curr. Eye Res. mil novecientos ochenta y dos; 2 : 735–742. [ PubMed ] [ Google Scholar ]
-
Shaheen SO, Sterne JA, Songhurst CE, Burney PG. Uso frecuente de paracetamol y asma en adultos. Tórax. 2000; 55 : 266–270. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sharma A, Kharb S, Chugh SN, Kakkar R, Singh GP. Efecto del control glucémico y la suplementación con vitamina E sobre el contenido total de glutatión en la diabetes mellitus no insulinodependiente. Ana. Nutr. Metab. 2000; 44 : 11-13. [ PubMed ] [ Google Scholar ]
-
Shaw JP, Chou IN. Elevación del contenido de glutatión intracelular asociado con la estimulación mitogénica de fibroblastos quiescentes. J. Cell. Physiol 1986; 129 : 193–198. [ PubMed ] [ Google Scholar ]
-
Shi ZZ, Osei-Frimpong J, Kala G, Kala SV, Barrios RJ, Habib GM, Lukin DJ, Danney CM, Matzuk MM, Lieberman MW. La síntesis de glutatión es esencial para el desarrollo del ratón, pero no para el crecimiento celular en cultivo. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 2000; 97 : 5101-5106. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sian J, Dexter DT, Lees AJ, Daniel S, Agid Y, Javoy-Agid F, Jenner P, Marsden CD. Alteraciones en los niveles de glutatión en la enfermedad de Parkinson y otros trastornos neurodegenerativos que afectan los ganglios basales. Ana. Neurol 1994; 36 : 348–355. [ PubMed ] [ Google Scholar ]
-
Sibhatu MB, Smitherman PK, Townsend AJ, Morrow CS. La expresión de MRP1 y GSTP1-1 modula la respuesta celular aguda al tratamiento con el isotiocianato quimiopreventivo, sulforafano. Carcinogénesis. 2008; 29 : 807–815. [ PubMed ] [ Google Scholar ]
-
Sido B, Hack V, Hochlehnert A, Lipps H, Herfarth C, Droge W. Deterioro de la síntesis de glutatión intestinal en pacientes con enfermedad inflamatoria intestinal. Intestino. 1998; 42 : 485–492. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Siedlinski M, Postma DS, van Diemen CC, Blokstra A, Smit HA, Boezen HM. Pérdida de la función pulmonar, tabaquismo, ingesta de vitamina C y polimorfismos de los genes de la glutamato-cisteína ligasa. A.m. J. Respir. Crit. Care Med. 2008; 178 : 13-19. [ PubMed ] [ Google Scholar ]
-
Sies H. Glutatión y su papel en las funciones celulares. Radic Libre. Biol. Medicina. 1999; 27 : 916–921. [ PubMed ] [ Google Scholar ]
-
Simmons TW, Hinchman CA, Ballatori N. Polaridad del flujo hepático de glutatión y glutatión S-conjugado, y formación de ácido mercaptúrico intraorganico en el patín. Biochem. Pharmacol 1991; 42 : 2221–2228. [ PubMed ] [ Google Scholar ]
-
Simmons TW, Anders MW, Ballatori N. Cisteína y transporte de S- (1,2-diclorovinil) -L-cisteína en vesículas de membrana canalicular del hígado de rata: mecanismos de reabsorción potencial para metabolitos biliares de glutatión y sus conjugados S. J. Pharmacol. Exp. El r. 1992; 262 : 1182-1188. [ PubMed ] [ Google Scholar ]
-
Singh A, Rangasamy T, Thimmulappa RK, Lee H, Osburn WO, Brigelius-Flohé R, Kensler TW, Yamamoto M, Biswal S. Glutatión peroxidasa 2, la principal isoforma inducible por humo de cigarrillo de GPX en los pulmones, está regulada por Nrf2. A.m. J. Respir. Célula. Mol. Biol. 2006; 35 : 639-650. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Snyder AH, McPherson ME, Hunt JF, Johnson M, Stamler JS, Gaston B. Efectos agudos de S-nitrosoglutatión en aerosol en la fibrosis quística. A.m. J. Respir. Crit. Care Med. 2002; 165 : 922–926. [ PubMed ] [ Google Scholar ]
-
Solano RM, Casarejos MJ, Menéndez-Cuervo J, Rodríguez-Navarro JA, García dY, Mena MA. Disfunción glial en ratones nulos parkin: efectos del envejecimiento. J. Neurosci. 2008; 28 : 598–611. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sontakke AN, Tara Tara. Una dualidad en los roles de las especies reactivas de oxígeno con respecto al metabolismo óseo. Clin. Chim. Acta 2002; 318 : 145–148. [ PubMed ] [ Google Scholar ]
-
Spencer JP, Jenner P, Daniel SE, Lees AJ, Marsden DC, Halliwell B. Conjugados de catecolaminas con cisteína y GSH en la enfermedad de Parkinson: posibles mecanismos de formación que involucran especies reactivas de oxígeno. J. Neurochem. 1998; 71 : 2112–2122. [ PubMed ] [ Google Scholar ]
-
Staal FJ, Roederer M, Herzenberg LA. Los tioles intracelulares regulan la activación del factor nuclear kappa B y la transcripción del virus de inmunodeficiencia humana. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1990; 87 : 9943–9947. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sternberg P, Jr, Davidson PC, Jones DP, Hagen TM, Reed RL, Drews-Botsch C. Protección del epitelio pigmentario de la retina contra el daño oxidativo por glutatión y precursores. Invertir. Oftalmol Vis. Sci. 1993; 34 : 3661–3668. [ PubMed ] [ Google Scholar ]
-
Suthanthiran M, Anderson ME, Sharma VK, Meister v. Glutatión regula la síntesis de ADN dependiente de la activación en linfocitos T humanos altamente purificados y estimulados a través de los antígenos CD2 y CD3. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1990; 87 : 3343–3347. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Sykes MC, Mowbray AL, Jo H. Glutatión reversible de caspasa-3 por glutaredoxina como un nuevo mecanismo de señalización redox en la muerte celular inducida por el factor de necrosis tumoral alfa. Circ. Res. 2007; 100 : 152-154. [ PubMed ] [ Google Scholar ]
-
Tanaka Y, Gleason CE, Tran PO, Harmon JS, Robertson RP. Prevención de la toxicidad de la glucosa en las células HIT-T15 y las ratas grasas diabéticas Zucker con antioxidantes. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1999; 96 : 10857-10862. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Tanaka Y, Tran PO, Harmon J, Robertson RP. Un papel para la glutatión peroxidasa en la protección de las células beta pancreáticas contra el estrés oxidativo en un modelo de toxicidad de glucosa. Proc Natl. Acad. Sci. ESTADOS UNIDOS. 2002; 99 : 12363–12368. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Tiedge M, Lortz S, Drinkgern J, Lenzen S. Relación entre la expresión del gen de la enzima antioxidante y el estado de defensa antioxidante de las células productoras de insulina. Diabetes. 1997; 46 : 1733-1742. [ PubMed ] [ Google Scholar ]
-
Tieu K, Ischiropoulos H, Przedborski S. Óxido nítrico y especies reactivas de oxígeno en la enfermedad de Parkinson. IUBMB. Vida. 2003; 55 : 329-335. [ PubMed ] [ Google Scholar ]
-
Tirouvanziam R, Conrad CK, Bottiglieri T, Herzenberg LA, Moss RB, Herzenberg LA. Las altas dosis de N-acetilcisteína oral, un profármaco de glutatión, modula la inflamación en la fibrosis quística. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 2006; 103 : 4628–4633. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Toffa S, Kunikowska GM, Zeng BY, Jenner P, Marsden CD. El agotamiento de glutatión en el cerebro de rata no causa la degeneración de la vía nigrostriatal. J. Neural Transm. 1997; 104 : 67-75. [ PubMed ] [ Google Scholar ]
-
Townsend DM, Tew KD, Tapiero H. La importancia del glutatión en la enfermedad humana. Biomed. Farmacista 2003; 57 : 145-155. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Trinh K, Moore K, Wes PD, Muchowski PJ, Dey J, Andrews L, Pallanck LJ. La inducción de la vía de desintoxicación de fase II suprime la pérdida de neuronas en los modelos de Drosophila de la enfermedad de Parkinson. J. Neurosci. 2008; 28 : 465–472. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Trocino RA, Akazawa S, Ishibashi M, Matsumoto K, Matsuo H, Yamamoto H, Goto S, Urata Y, Kondo T, Nagataki S. Importancia del agotamiento de glutatión y el estrés oxidativo en la embriogénesis temprana en cultivo de embriones de rata inducido por glucosa. Diabetes. 1995; 44 : 992–998. [ PubMed ] [ Google Scholar ]
-
Uhlig S, Wendel A. Las consecuencias fisiológicas de las variaciones de glutatión. Life Sci. 1992; 51 : 1083-1094. [ PubMed ] [ Google Scholar ]
-
Urata Y, Yamamoto H, Goto S, Tsushima H, Akazawa S, Yamashita S, Nagataki S, Kondo T. La exposición prolongada a altas concentraciones de glucosa deteriora la expresión sensible de la gamma-glutamilcisteína sintetasa por la interleucina-1beta y el factor de necrosis tumoral alfa en células endoteliales de ratón. J. Biol. Chem 1996; 271 : 15146–15152. [ PubMed ] [ Google Scholar ]
-
Vali S, Mythri RB, Jagatha B, Padiadpu J, Ramanujan KS, Andersen JK, Gorin F, Bharath MM. Integrando el metabolismo del glutatión y la disfunción mitocondrial con implicaciones para la enfermedad de Parkinson: un modelo dinámico. Neurociencia 2007; 149 : 917–930. [ PubMed ] [ Google Scholar ]
-
Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Radicales libres y antioxidantes en funciones fisiológicas normales y enfermedades humanas. En t. J. Biochem. Cell Biol. 2007; 39 : 44-84. [ PubMed ] [ Google Scholar ]
-
van den Dobbelsteen DJ, Nobel CS, Schlegel J, Cotgreave IA, Orrenius S, Slater AF. Flujo rápido y específico de glutatión reducido durante la apoptosis inducida por el anticuerpo anti-Fas / APO-1. J. Biol. Chem 1996; 271 : 15420-15427. [ PubMed ] [ Google Scholar ]
-
van der Toorn M, Smit-de Vries MP, Slebos DJ, de Bruin HG, Abello N, van Oosterhout AJ, Bischoff R, Kauffman HF. El humo del cigarrillo modifica irreversiblemente el glutatión en las células epiteliales de las vías respiratorias. A.m. J. Physiol. Célula pulmonar. Mol. Physiol 2007; 293 : L1156 – L1162. [ PubMed ] [ Google Scholar ]
-
Veis DJ, Sorenson CM, Shutter JR, Korsmeyer SJ. Los ratones con deficiencia de Bcl-2 demuestran apoptosis linfoide fulminante, riñones poliquísticos y cabello hipopigmentado. Célula. 1993; 75 : 229–240. [ PubMed ] [ Google Scholar ]
-
Velsor LW, van Heeckeren A, Día BJ. Desequilibrio antioxidante en los pulmones de ratones mutantes proteicos reguladores de la conductancia transmembrana de la fibrosis quística. A.m. J. Physiol. Lung Cell Mol. Physiol 2001; 281 : L31 – L38. [ PubMed ] [ Google Scholar ]
-
Viña J, Lloret A, Ortí R, Alonso D. Bases moleculares del tratamiento de la enfermedad de Alzheimer con antioxidantes: prevención del estrés oxidativo. Mol. Aspectos Med. 2004; 25 : 117-123. [ PubMed ] [ Google Scholar ]
-
Viveros MP, Arranz L, Hernanz A, Miquel J, De la Fuente M. Un modelo de envejecimiento prematuro en ratones basado en la respuesta conductual alterada relacionada con el estrés y la inmunosenescencia. Neuroinmunomodulación. 2007; 14 : 157-162. [ PubMed ] [ Google Scholar ]
-
Vlaming MLH, Mohrmann K, Wagenaar E, de Waart DR, Oude Elferink RPJ, Lagas JS, van Telligen O, Vainchtein LD, Rosing H, Beijnen JH, Schellens JHM, Schinkel AH. Transporte de fármacos cancerígenos y anticancerígenos por Mrp2 in vivo : estudios con ratones knockout Mrp2 (Abcc2). J. Pharmacol. Exp. El r. 2006; 318 : 319–327. [ PubMed ] [ Google Scholar ]
-
Vogel JU, Cinatl J, Dauletbaev N, Buxbaum S, Treusch G, Cinatl J, Jr, Gerein V, Doerr HW. Efectos del S-acetilglutatión en el modelo celular y animal de la infección por el virus del herpes simple tipo 1. Medicina. Microbiol Immunol 2005; 194 : 55–59. [ PubMed ] [ Google Scholar ]
-
Wang W, Ballatori N. Conjugados de glutatión endógeno: ocurrencia y funciones biológicas. Pharmacol Rev. 1998; 50 : 335–356. [ PubMed ] [ Google Scholar ]
-
Wasserman WW, Fahl WE. Elementos funcionales que responden a los antioxidantes. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 1997; 94 : 5361-5366. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Whitworth AJ, Theodore DA, Greene JC, Benes H, Wes PD, Pallanck LJ. El aumento de la actividad glutatión S-transferasa rescata la pérdida de neuronas dopaminérgicas en un modelo de Drosophila de la enfermedad de Parkinson. Proc. Natl. Acad. Sci. ESTADOS UNIDOS. 2005; 102 : 8024–8029. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Widder JD, Guzik TJ, Mueller CF, Clempus RE, Schmidt HH, Dikalov SI, Griendling KK, Jones DP, Harrison DG. Papel de la proteína de resistencia a múltiples fármacos 1 en la hipertensión y la disfunción vascular causada por la angiotensina II. Arterioscler. Trombo Vasc. Biol. 2007; 27 : 762–768. [ PubMed ] [ Google Scholar ]
-
Wijnholds J, Scheffer GL, van der Valk M, van der Valk P, Beijnen JH, Scheper RJ, Borst P. La proteína de resistencia a múltiples fármacos 1 protege la capa mucosa orofaríngea y los túbulos testiculares contra el daño inducido por fármacos. J. Exp. Medicina. 1998; 188 : 797–808. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
AC salvaje, Mulcahy RT. Regulación de la expresión del gen de la subunidad gamma-glutamilcisteína sintetasa: información sobre el control transcripcional de las defensas antioxidantes. Radic Libre. Res. 2000; 32 : 281–301. [ PubMed ] [ Google Scholar ]
-
Won JS, Singh I. Señalización de esfingolípidos y regulación redox. Radic Libre. Biol. Medicina. 2006; 40 : 1875-1888. [ PubMed ] [ Google Scholar ]
-
Yang CS, Chou ST, Lin NN, Liu L, Tsai PJ, Kuo JS, Lai JS. Determinación de glutatión extracelular en cerebro de rata por microdiálisis y cromatografía líquida de alta resolución con detección de fluorescencia. J. Chromatogr. Biomed. Appl. 1994; 661 : 231–235. [ PubMed ] [ Google Scholar ]
-
Yang Y, Dieter MZ, Chen Y, Shertzer HG, Nebert DW, Dalton TP. Caracterización inicial de la subunidad modificadora de glutamato-cisteína ligasa Gclm (- / -) ratón inactivo. Sistema de modelo novedoso para una respuesta al estrés oxidativo severamente comprometida. J. Biol. Chem 2002; 277 : 49446–49452. [ PubMed ] [ Google Scholar ]
-
Yoshida K, Hirokawa J, Tagami S, Kawakami Y, Urata Y, Kondo T. Actividad debilitadora de eliminación celular contra el estrés oxidativo en la diabetes mellitus: regulación de la síntesis de glutatión y el flujo de salida. Diabetologia. 1995; 38 : 201–210. [ PubMed ] [ Google Scholar ]
-
Young RW. Fisiopatología de la degeneración macular relacionada con la edad. Surv. Oftalmol 1987; 31 : 291–306. [ PubMed ] [ Google Scholar ]
-
Young RW. Radiación solar y degeneración macular relacionada con la edad. Surv. Oftalmol 1988; 32 : 252–269. [ PubMed ] [ Google Scholar ]
-
Zaman K, McPherson M, Vaughan J, Hunt J, Mendes F, Gaston B, Palmer LA. El S-nitrosoglutatión aumenta la maduración del regulador transmembrana de la fibrosis quística. Biochem. Biophys Res. Commun. 2001; 284 : 65-70. [ PubMed ] [ Google Scholar ]
-
Zargari M, Allameh A, Sanati MH, Tiraihi T, Lavasani S, Emadyan O. Relación entre la puntuación clínica y la desmielinización en el sistema nervioso central con la capacidad antioxidante total del plasma durante el desarrollo experimental de encefalomielitis autoinmune en ratones. Neurosci. Letón. 2007; 412 : 24-28. [ PubMed ] [ Google Scholar ]
-
Zeevalk GD, Bernard LP, Sinha C, Ehrhart J, Nicklas WJ. Excitotoxicidad y estrés oxidativo durante la inhibición del metabolismo energético. Dev. Neurosci. 1998; 20 : 444–453. [ PubMed ] [ Google Scholar ]
-
Zeevalk GD, Manzino L, Sonsalla PK, Bernard LP. Caracterización de la elevación intracelular de glutatión (GSH) con glutatión monoetil éster y GSH en cultivos cerebrales y neuronales: relevancia para la enfermedad de Parkinson. Exp. Neurol 2007; 203 : 512–520. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
-
Zeevalk GD, Razmpour R, Bernard LP. Glutatión y enfermedad de Parkinson: ¿es este el elefante en la habitación? Biomed. Farmacista 2008; 62 : 236–249. [ PubMed ] [ Google Scholar ]
-
Zipser Y, Piade A, Kosower NS. El estado del tiol eritrocitario regula el nivel de fosfotirosina de la banda 3 mediante la oxidación / reducción de la fosfotirosina fosfatasa asociada a la banda 3. FEBS Lett. 1997; 406 : 126-130. [ PubMed ] [ Google Scholar ]